რეაქციების მექანიზმი. რა არის რეაქციის მექანიზმები ორგანულ ქიმიაში? ქიმიური რეაქციების კლასიფიკაცია მექანიზმების მიხედვით
ქიმიური რეაქციების სახეები არაორგანულ და ორგანულ ქიმიაში.
1. ქიმიური რეაქცია არის პროცესი, რომლის დროსაც სხვა ნივთიერებები წარმოიქმნება ერთი ნივთიერებისგან. პროცესის ბუნებიდან გამომდინარე, განასხვავებენ ქიმიური რეაქციების ტიპებს.
1) საბოლოო შედეგის მიხედვით
2) სითბოს გამოყოფის ან შთანთქმის საფუძველზე
3) რეაქციის შექცევადობაზე დაყრდნობით
4) რეაქტიული ნივთიერებების შემადგენელი ატომების ჟანგვის მდგომარეობის ცვლილებებზე დაყრდნობით
საბოლოო შედეგის მიხედვით, რეაქციები შემდეგი ტიპისაა:
ა) ჩანაცვლება: RH+Cl 2 →RCl+HCl
ბ) შეერთება: CH 2 =CH 2 +Cl 2 →CH 2 Cl-CH 2 Cl
ბ) ელიმინაცია: CH 3 -CH 2 OH → CH 2 =CH 2 + H 2 O
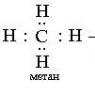
დ) დაშლა: CH 4 →C+2H 2
დ) იზომერიზაცია
ე) გაცვლა
ზ) კავშირები
დაშლის რეაქციაარის პროცესი, რომლის დროსაც ერთი ნივთიერებისგან ორი ან მეტი სხვა წარმოიქმნება.
გაცვლის რეაქციაეს არის პროცესი, რომლის დროსაც რეაქციაში მყოფი ნივთიერებები ცვლის მათ შემადგენელ ნაწილებს.
ჩანაცვლების რეაქციებიხდება მარტივი და რთული ნივთიერებების მონაწილეობით, რის შედეგადაც წარმოიქმნება ახალი მარტივი და რთული ნივთიერებები.
Როგორც შედეგი ნაერთი რეაქციებიორი ან მეტი ნივთიერებისგან წარმოიქმნება ერთი ახალი.
სითბოს გათავისუფლების ან შთანთქმის საფუძველზე, რეაქციები შემდეგი ტიპისაა:
ა) ეგზოთერმული
ბ) ენდოთერმული
ეგზოთერმული -ეს არის რეაქციები, რომლებიც წარმოიქმნება სითბოს გათავისუფლებით.
ენდოთერმული- ეს არის რეაქციები, რომლებიც ხდება გარემოდან სითბოს შეწოვით.
შექცევადობის მიხედვით, რეაქციები შემდეგი ტიპისაა:
ა) შექცევადი
ბ) შეუქცევადია
რეაქციებს, რომლებიც მიმდინარეობს მხოლოდ ერთი მიმართულებით და მთავრდება საწყისი რეაქტორების სრული გარდაქმნით საბოლოო ნივთიერებებად, ეწოდება შეუქცევადი.
შექცევადირეაქციებს, რომლებიც ერთდროულად ხდება ორი ურთიერთსაპირისპირო მიმართულებით, ეწოდება.
რეაქტიული ნივთიერებების შემადგენელი ატომების ჟანგვის მდგომარეობის ცვლილებებიდან გამომდინარე, რეაქციები შემდეგი ტიპისაა:
ა) რედოქსი
რეაქციები, რომლებიც წარმოიქმნება ატომების ჟანგვის მდგომარეობის ცვლილებით (როდესაც ელექტრონები გადადიან ერთი ატომიდან, მოლეკულიდან ან იონიდან მეორეზე) ე.წ. რედოქსი.
2. რეაქციის მექანიზმის მიხედვით, რეაქციები იყოფა იონურ და რადიკალურად.
იონური რეაქციებიიონებს შორის ურთიერთქმედება ქიმიური ბმის ჰეტეროლიზური რღვევის შედეგად (ელექტრონების წყვილი მთლიანად მიდის ერთ-ერთ „ფრაგმენტში“).
იონური რეაქციები ორი ტიპისაა (რეაგენტის ტიპის მიხედვით):
ა) ელექტროფილური - ელექტროფილთან რეაქციის დროს.
ელექტროფილი- ჯგუფი, რომელსაც აქვს თავისუფალი ორბიტალები ან ცენტრები შემცირებული ელექტრონის სიმკვრივით ზოგიერთ ატომში (მაგალითად: H +, Cl - ან AlCl 3)
ბ) ნუკლეოფილური – ნუკლეოფილთან ურთიერთობისას
ნუკლეოფილი -უარყოფითად დამუხტული იონი ან მოლეკულა მარტოხელა ელექტრონული წყვილით (ამჟამად არ მონაწილეობს ქიმიური ბმის ფორმირებაში).
(მაგალითები: F - , Cl - , RO - , I -).
რეალური ქიმიური პროცესები იშვიათად შეიძლება აღწერილი იყოს მარტივი მექანიზმებით. ქიმიური პროცესების დეტალური გამოკვლევა მოლეკულური კინეტიკური თვალსაზრისით გვიჩვენებს, რომ მათი უმეტესობა მიმდინარეობს რადიკალური ჯაჭვის მექანიზმის გასწვრივ; ჯაჭვური რეაქციების თავისებურებაა თავისუფალი რადიკალების წარმოქმნა შუალედურ ეტაპებზე (მოლეკულების არასტაბილური ფრაგმენტები ან ატომები ხანმოკლე სიცოცხლის ხანგრძლივობით. , ყველას აქვს უფასო კომუნიკაცია.
წვის, აფეთქების, ჟანგვის, ფოტოქიმიური რეაქციების და ბიოქიმიური რეაქციების პროცესები ცოცხალ ორგანიზმებში მიმდინარეობს ჯაჭვის მექანიზმით.
ჯაჭვის სისტემას აქვს რამდენიმე ეტაპი:
1) ჯაჭვის ნუკლეაცია - ჯაჭვური რეაქციების ეტაპი, რის შედეგადაც თავისუფალი რადიკალები წარმოიქმნება ვალენტობით გაჯერებული მოლეკულებიდან.
2) ჯაჭვის გაგრძელება - წრიული ჯაჭვის ეტაპი, რომელიც მიმდინარეობს თავისუფალი საფეხურების საერთო რაოდენობის შენარჩუნებით.
3) ჯაჭვის გაწყვეტა - პროცესების ჯაჭვის ელემენტარული ეტაპი, რომელიც იწვევს თავისუფალი ობლიგაციების გაქრობას.
არსებობს განშტოებული და განშტოებული ჯაჭვური რეაქციები.
ჯაჭვის ერთ-ერთი ყველაზე მნიშვნელოვანი კონცეფციაა ჯაჭვის სიგრძე- ჯაჭვის გაგრძელების ელემენტარული ეტაპების საშუალო რაოდენობა თავისუფალი რადიკალის გამოჩენის შემდეგ მის გაქრობამდე.
მაგალითი: წყალბადის ქლორიდის სინთეზი
1) CL 2 შთანთქავს ენერგიის კვანტს და რადიკალ 2-ის გამოსახულებას: CL 2 +hv=CL * +CL *
2) აქტიური ნაწილაკი აერთიანებს m-მოლეკულას H 2 წყალბადის ქლორიდს და აქტიური ნაწილაკი H 2: CL 1 + H 2 = HCL + H *
3)CL 1 +H 2 =HCL+CL * და ა.შ.
6)H * +CL * =HCL - ღია წრე.
განშტოებული მექანიზმი:
F * +H 2 =HF+H * და ა.შ.
F * +H 2 =HF+H * და ა.შ.
წყალში უფრო რთულია - წარმოიქმნება OH*, O* რადიკალები და H* რადიკალები.
რეაქციები, რომლებიც წარმოიქმნება მაიონებელი გამოსხივების გავლენის ქვეშ: რენტგენის სხივები, კათოდური სხივები და ა.შ. რადიოქიმიური ეწოდება.
მოლეკულების რადიაციასთან ურთიერთქმედების შედეგად შეინიშნება მოლეკულების დაშლა ყველაზე რეაქტიული ნაწილაკების წარმოქმნით.
ასეთი რეაქციები ხელს უწყობს ნაწილაკების რეკომბინაციას და მათი სხვადასხვა კომბინაციით ნივთიერებების წარმოქმნას.
ამის მაგალითია ჰიდრაზინი N 2 H 4 - რაკეტის საწვავის კომპონენტი. ბოლო დროს გაკეთდა მცდელობები ამიაკისგან ჰიდრაზინის მიღებაზე γ-სხივების ზემოქმედების შედეგად:
NH 3 → NH 2 * + H*
2NH 2 *→ N 2 H 4
რადიოქიმიური რეაქციები, მაგალითად, წყლის რადიოლიზი, მნიშვნელოვანია ორგანიზმების სიცოცხლისთვის.
ლიტერატურა:
1. ახმეტოვი, ნ.ს. ზოგადი და არაორგანული ქიმია / N.S. ახმეტოვი. - მე-3 გამოცემა. – მ.: უმაღლესი სკოლა, 2000. – 743გვ.
- კოროვინი ნ.ვ. ზოგადი ქიმია / N.V. Korovin. – მ.: უმაღლესი სკოლა, 2006. – 557გვ.
- კუზმენკო ნ.ე. მოკლე კურსი ქიმიაში / N.E. კუზმენკო, ვ.ვ.ერემინი, ვ.ა. პოპკოვი. – მ.: უმაღლესი სკოლა, 2002. – 415გვ.
- ზაიცევი, ო.ს. ზოგადი ქიმია. ნივთიერებების სტრუქტურა და ქიმიური რეაქციები / O.S. Zaitsev. – მ.: ქიმია, 1990 წ.
- კარაპეტიანცი, მ.ხ. მატერიის სტრუქტურა / მ.ხ. კარაპეტიანცი, S.I. Drakin. – მ.: უმაღლესი სკოლა, 1981 წ.
- კოტონი F. არაორგანული ქიმიის საფუძვლები / F. Cotton, J. Wilkinson. – მ.: მირი, 1981 წ.
- უგაი, ია.ა. ზოგადი და არაორგანული ქიმია / Ya.A.Ugai. – მ.: უმაღლესი სკოლა, 1997 წ.
ორგანული რეაქციების მექანიზმები
| პარამეტრის სახელი | მნიშვნელობა |
| სტატიის თემა: | ორგანული რეაქციების მექანიზმები |
| რუბრიკა (თემატური კატეგორია) | Განათლება |
რეაქციების კლასიფიკაცია
არსებობს ოთხი ძირითადი ტიპის რეაქცია, რომელშიც ორგანული ნაერთები მონაწილეობენ: ჩანაცვლება (გადაადგილება), დამატება, აღმოფხვრა (ელიმინაცია), გადაწყობა.
3.1 ჩანაცვლების რეაქციები
პირველი ტიპის რეაქციაში ჩანაცვლება ჩვეულებრივ ხდება ნახშირბადის ატომში, მაგრამ შემცვლელი ატომი უნდა იყოს წყალბადის ატომი ან სხვა ატომი ან ატომების ჯგუფი. ელექტროფილური ჩანაცვლების დროს წყალბადის ატომი ყველაზე ხშირად იცვლება; მაგალითია კლასიკური არომატული ჩანაცვლება:
ნუკლეოფილური ჩანაცვლებით, ყველაზე ხშირად იცვლება არა წყალბადის ატომი, არამედ სხვა ატომები, მაგალითად:
NC - + R−Br → NC−R +BR -
3.2 დანამატის რეაქციები
დანამატის რეაქციები ასევე შეიძლება იყოს ელექტროფილური, ნუკლეოფილური ან რადიკალური, პროცესის დაწყების სახეობების მიხედვით. ჩვეულებრივ ნახშირბად-ნახშირბადის ორმაგ ბმებთან მიმაგრება ჩვეულებრივ გამოწვეულია ელექტროფილით ან რადიკალით. მაგალითად, HBr-ის დამატება
შეიძლება დაიწყოს H+ პროტონის ან Br· რადიკალის მიერ ორმაგი ბმის შეტევით.
3.3 ელიმინაციის რეაქციები
ელიმინაციის რეაქციები არსებითად დამატების რეაქციების საპირისპიროა; ასეთი რეაქციის ყველაზე გავრცელებული ტიპია წყალბადის ატომის და სხვა ატომის ან ჯგუფის აღმოფხვრა მეზობელი ნახშირბადის ატომებიდან ალკენების წარმოქმნით:
3.4 გადაწყობის რეაქციები
გადაწყობა ასევე შეიძლება მოხდეს შუალედური ნაერთების მეშვეობით, რომლებიც არის კათიონები, ანიონები ან რადიკალები; ყველაზე ხშირად, ეს რეაქციები წარმოიქმნება კარბოკაციონების ან სხვა ელექტრონის დეფიციტის ნაწილაკების წარმოქმნით. გადაწყობა შეიძლება მოიცავდეს ნახშირბადის ჩონჩხის მნიშვნელოვან რესტრუქტურიზაციას. თავად გადაწყობის საფეხურს ასეთ რეაქციებში ხშირად მოჰყვება ჩანაცვლების, დამატების ან აღმოფხვრის საფეხურები, რაც იწვევს სტაბილური საბოლოო პროდუქტის ფორმირებას.
ქიმიური რეაქციის დეტალურ აღწერას ეტაპობრივად, ჩვეულებრივ, მექანიზმს უწოდებენ. ელექტრონული თვალსაზრისით, ქიმიური რეაქციის მექანიზმი გაგებულია, როგორც მოლეკულებში კოვალენტური ბმების გაწყვეტის მეთოდი და მდგომარეობების თანმიმდევრობა, რომლებშიც რეაქტიული ნივთიერებები გადიან რეაქციის პროდუქტებად გადაქცევამდე.
4.1 თავისუფალი რადიკალების რეაქციები
თავისუფალი რადიკალების რეაქციები არის ქიმიური პროცესები, რომლებშიც მონაწილეობენ მოლეკულები დაუწყვილებელი ელექტრონებით. თავისუფალი რადიკალების რეაქციების ზოგიერთი ასპექტი უნიკალურია სხვა ტიპის რეაქციებთან შედარებით. მთავარი განსხვავება ისაა, რომ ბევრი თავისუფალი რადიკალების რეაქცია ჯაჭვური რეაქციაა. ეს ნიშნავს, რომ არსებობს მექანიზმი, რომლითაც მრავალი მოლეკულა გარდაიქმნება პროდუქტად განმეორებითი პროცესის მეშვეობით, რომელიც დაწყებულია ერთი რეაქტიული სახეობის შექმნით. ტიპიური მაგალითი ილუსტრირებულია შემდეგი ჰიპოთეტური მექანიზმის გამოყენებით:
სტადიას, რომელზედაც წარმოიქმნება რეაქციის შუალედი, ამ შემთხვევაში A·, ჩვეულებრივ ინიცირებას უწოდებენ. ეს ეტაპი ხდება მაღალ ტემპერატურაზე, ულტრაიისფერი სხივების ან პეროქსიდების გავლენის ქვეშ, არაპოლარულ გამხსნელებში. შემდეგი ოთხი განტოლება ამ მაგალითში იმეორებს ორი რეაქციის თანმიმდევრობას; ისინი წარმოადგენენ ჯაჭვის განვითარების ფაზას. ჯაჭვური რეაქციები ხასიათდება ჯაჭვის სიგრძით, რომელიც შეესაბამება განვითარების ეტაპების რაოდენობას დაწყების ეტაპზე. მეორე ეტაპი ხდება ნაერთის ერთდროული სინთეზით და ახალი რადიკალის წარმოქმნით, რომელიც აგრძელებს გარდაქმნების ჯაჭვს. ბოლო საფეხური არის ჯაჭვის შეწყვეტის საფეხური, რომელიც მოიცავს ნებისმიერ რეაქციას, რომელშიც განადგურებულია ჯაჭვის პროგრესირებისთვის აუცილებელი რეაქციის ერთ-ერთი შუამავალი. რაც უფრო მეტი ეტაპია ჯაჭვის შეწყვეტა, მით უფრო მოკლე ხდება ჯაჭვის სიგრძე.
თავისუფალი რადიკალების რეაქციები ხდება: 1) შუქზე, მაღალ ტემპერატურაზე ან სხვა ნივთიერებების დაშლის დროს წარმოქმნილი რადიკალების არსებობისას; 2) ინჰიბირებულია ნივთიერებებით, რომლებიც ადვილად რეაგირებენ თავისუფალ რადიკალებთან; 3) გვხვდება არაპოლარულ გამხსნელებში ან ორთქლის ფაზაში; 4) ხშირად აქვთ ავტოკატალიტიკური და ინდუქციური პერიოდი რეაქციის დაწყებამდე; 5) კინეტიკურად ისინი ჯაჭვია.
რადიკალური ჩანაცვლების რეაქციები დამახასიათებელია ალკანებისთვის, ხოლო რადიკალური დამატების რეაქციები დამახასიათებელია ალკენებისა და ალკინებისთვის.
CH 4 + Cl 2 → CH 3 Cl + HCl
CH 3 -CH=CH 2 + HBr → CH 3 -CH 2 -CH 2 Br
CH 3 -C≡CH + HCl → CH 3 -CH=CHCl
თავისუფალი რადიკალების ერთმანეთთან შეერთება და ჯაჭვის შეწყვეტა ძირითადად ხდება რეაქტორის კედლებზე.
4.2 იონური რეაქციები
რეაქციები, რომლებშიც ის ხდება ჰეტეროლიზურიბმების გაწყვეტას და იონური ტიპის შუალედური ნაწილაკების წარმოქმნას იონური რეაქციები ეწოდება.
იონური რეაქციები ხდება: 1) კატალიზატორების თანდასწრებით (მჟავები ან ფუძეები და არ მოქმედებს სინათლის ან თავისუფალი რადიკალების, განსაკუთრებით პეროქსიდების დაშლის შედეგად წარმოქმნილი); 2) არ ზემოქმედებენ თავისუფალი რადიკალების გამწმენდი საშუალებებით; 3) გამხსნელის ბუნება გავლენას ახდენს რეაქციის მიმდინარეობაზე; 4) იშვიათად გვხვდება ორთქლის ფაზაში; 5)კინეტიკურად ისინი ძირითადად პირველი ან მეორე რიგის რეაქციებია.
მოლეკულაზე მოქმედი რეაგენტის ბუნებიდან გამომდინარე, იონური რეაქციები იყოფა ელექტროფილურიდა ნუკლეოფილური. ნუკლეოფილური ჩანაცვლების რეაქციები დამახასიათებელია ალკილისა და არილის ჰალოგენებისთვის,
CH 3 Cl + H 2 O → CH 3 OH + HCl
C 6 H 5 -Cl + H 2 O → C 6 H 5 -OH + HCl
C 2 H 5 OH + HCl → C 2 H 5 Cl + H 2 O
C 2 H 5 NH 2 + CH 3 Cl → CH 3 -NH-C 2 H 5 + HCl
ელექტროფილური ჩანაცვლება - ალკანებისთვის კატალიზატორების თანდასწრებით
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH (CH 3) - CH 2 -CH 3
და არენები.
C 6 H 6 + HNO 3 + H 2 SO 4 → C 6 H 5 -NO 2 + H 2 O
ალკენებისთვის დამახასიათებელია ელექტროფილური დამატების რეაქციები
CH 3 -CH=CH 2 + Br 2 → CH 3 -CHBr-CH 2 Br
და ალკინები,
CH≡CH + Cl 2 → CHCl=CHCl
ნუკლეოფილური დანამატი – ალკინებისთვის.
CH 3 -C≡CH + C 2 H 5 OH + NaOH → CH 3 -C(OC 2 H 5) = CH 2
ორგანული რეაქციების მექანიზმები - ცნება და ტიპები. კატეგორიის კლასიფიკაცია და მახასიათებლები "ორგანული რეაქციების მექანიზმები" 2017, 2018 წ.
CH 3 -CH 3 + Cl 2 – (hv) ---- CH 3 -CH 2 Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
დანამატის რეაქციები
ასეთი რეაქციები დამახასიათებელია მრავალჯერადი (ორმაგი ან სამმაგი) ბმის შემცველი ორგანული ნაერთებისთვის. ამ ტიპის რეაქციები მოიცავს ალკენებსა და ალკინებში ჰალოგენების, წყალბადის ჰალოგენების და წყლის დამატების რეაქციებს.
CH3 -CH=CH2 + HCl ---- CH3 -CH(Cl)-CH3
ელიმინაციის რეაქციები
ეს არის რეაქციები, რომლებიც იწვევს მრავალი ბმის წარმოქმნას. წყალბადის ჰალოიდების და წყლის აღმოფხვრისას შეინიშნება რეაქციის გარკვეული სელექციურობა, რომელიც აღწერილია ზაიცევის წესით, რომლის მიხედვითაც წყალბადის ატომი გამოიყოფა ნახშირბადის ატომიდან, სადაც წყალბადის ატომები ნაკლებია. მაგალითი რეაქცია
CH3-CH(Cl)-CH 2 -CH 3 + KOH →CH 3 -CH = CH-CH 3 + HCl
პოლიმერიზაცია და პოლიკონდენსაცია
n(CH 2 =CHCl) (-CH 2 -CHCl)n
რედოქსი
ჟანგვითი რეაქციებიდან ყველაზე ინტენსიური არის წვა, რეაქცია, რომელიც დამახასიათებელია ორგანული ნაერთების ყველა კლასისთვის. ამ შემთხვევაში, წვის პირობებიდან გამომდინარე, ნახშირბადი იჟანგება C (ჭვარტლში), CO ან CO 2-მდე და წყალბადი გარდაიქმნება წყალში. თუმცა, ორგანული ქიმიკოსებისთვის, ჟანგვის რეაქციები, რომლებიც წარმოიქმნება ბევრად უფრო მსუბუქ პირობებში, ვიდრე წვა, დიდი ინტერესია. გამოყენებული ჟანგვის აგენტები: Br2-ის ხსნარები წყალში ან Cl2 CCl4-ში; KMnO 4 წყალში ან განზავებულ მჟავაში; სპილენძის ოქსიდი; ახლად დალექილი ვერცხლის(I) ან სპილენძის(II) ჰიდროქსიდები.
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
ესტერიფიკაცია (და მისი საპირისპირო ჰიდროლიზის რეაქცია)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Cycloaddition
Y R Y-R
‖ + ‖ → ǀ ǀ
R Y R-Y
‖ + →
11. ორგანული რეაქციების კლასიფიკაცია მექანიზმის მიხედვით. მაგალითები.
რეაქციის მექანიზმი მოიცავს ქიმიური რეაქციების დეტალურ ეტაპობრივ აღწერას. ამასთან, დგინდება, რომელი კოვალენტური ბმები წყდება, რა თანმიმდევრობით და რა გზით. ასევე საგულდაგულოდ არის აღწერილი რეაქციის პროცესში ახალი ბმების წარმოქმნა. რეაქციის მექანიზმის განხილვისას, უპირველეს ყოვლისა, ყურადღება მიაქციეთ რეაგირების მოლეკულაში კოვალენტური ბმის გაწყვეტის მეთოდს. არსებობს ორი ასეთი გზა - ჰომოლიზური და ჰეტეროლიზური.
რადიკალური რეაქციებიმიმდინარეობს კოვალენტური ბმის ჰომლიზური (რადიკალური) გაწყვეტით:

არაპოლარული ან დაბალპოლარული კოვალენტური ბმები (C–C, N–N, C–H) განიცდიან რადიკალურ რღვევას მაღალ ტემპერატურაზე ან სინათლის გავლენის ქვეშ. CH 3 რადიკალში ნახშირბადს აქვს 7 გარე ელექტრონი (CH 4-ში სტაბილური ოქტეტის გარსის ნაცვლად). რადიკალები არასტაბილურია; ისინი მიდრეკილნი არიან დაიჭირონ დაკარგული ელექტრონი (წყვილამდე ან ოქტეტამდე). სტაბილური პროდუქტების ფორმირების ერთ-ერთი გზაა დიმერიზაცია (ორი რადიკალის კომბინაცია):
CH 3 + CH 3 CH 3 : CH 3,
N + N N : ნ.
რადიკალური რეაქციები - ეს არის, მაგალითად, ალკანების ქლორირების, ბრომირების და ნიტრაციის რეაქციები:

იონური რეაქციები წარმოიქმნება ჰეტეროლიზური ბმის დაშლით. ამ შემთხვევაში, ხანმოკლე ორგანული იონები - კარბოკაციონები და კარბანიონები - ნახშირბადის ატომზე მუხტით შუალედურად წარმოიქმნება. იონურ რეაქციებში შემაკავშირებელი ელექტრონული წყვილი არ არის გამოყოფილი, მაგრამ მთლიანად გადადის ერთ-ერთ ატომში და აქცევს მას ანიონად:

ძლიერ პოლარული (H–O, C–O) და ადვილად პოლარიზებადი (C–Br, C–I) ბმები მიდრეკილია ჰეტეროლიზური გახლეჩისკენ.
გამოარჩევენ ნუკლეოფილური რეაქციები (ნუკლეოფილი– ვეძებთ ბირთვს, ადგილს ელექტრონების ნაკლებობით) და ელექტროფილური რეაქციები (ელექტროფილი– ვეძებთ ელექტრონებს). განცხადება, რომ კონკრეტული რეაქცია არის ნუკლეოფილური ან ელექტროფილური, ყოველთვის ეხება რეაგენტს. Რეაგენტი– რეაქციაში მონაწილე ნივთიერება უფრო მარტივი სტრუქტურით. სუბსტრატი– საწყისი ნივთიერება უფრო რთული სტრუქტურით. გამავალი ჯგუფიარის შესაცვლელი იონი, რომელიც მიბმულია ნახშირბადთან. რეაქციის პროდუქტი– ახალი ნახშირბადის შემცველი ნივთიერება (ჩაწერილია რეაქციის განტოლების მარჯვენა მხარეს).
TO ნუკლეოფილური რეაგენტები(ნუკლეოფილები) მოიცავს უარყოფითად დამუხტულ იონებს, ნაერთებს ელექტრონების მარტოხელა წყვილით, ნაერთებს ორმაგი ნახშირბად-ნახშირბადის ბმებით. TO ელექტროფილური რეაგენტები(ელექტროფილები) მოიცავს დადებითად დამუხტულ იონებს, ნაერთებს შეუვსებელი ელექტრონული გარსებით (AlCl 3, BF 3, FeCl 3), ნაერთებს კარბონილის ჯგუფებთან, ჰალოგენებთან. ელექტროფილები არის ნებისმიერი ატომი, მოლეკულა ან იონი, რომელსაც შეუძლია დაამატოს წყვილი ელექტრონები ახალი ბმის ფორმირების პროცესში. იონური რეაქციების მამოძრავებელი ძალა არის საპირისპიროდ დამუხტული იონების ან სხვადასხვა მოლეკულის ფრაგმენტების ურთიერთქმედება ნაწილობრივი მუხტით (+ და –).
ორგანული ნივთიერებების რეაქციები შეიძლება დაიყოს ოთხ ძირითად ტიპად: ჩანაცვლება, დამატება, ელიმინაცია (ელიმინაცია) და გადაწყობა (იზომერიზაცია). აშკარაა, რომ ორგანული ნაერთების რეაქციების მთელი მრავალფეროვნება არ შეიძლება შემცირდეს შემოთავაზებულ კლასიფიკაციამდე (მაგალითად, წვის რეაქციები). თუმცა, ასეთი კლასიფიკაცია ხელს შეუწყობს თქვენთვის უკვე ნაცნობ არაორგანულ ნივთიერებებს შორის არსებულ რეაქციებს ანალოგიების ჩამოყალიბებაში.
როგორც წესი, რეაქციაში მონაწილე ძირითად ორგანულ ნაერთს ე.წ სუბსტრატიდა სხვა რეაქციის კომპონენტი პირობითად განიხილება როგორც რეაგენტი.
ჩანაცვლების რეაქციები
ჩანაცვლების რეაქციები- ეს არის რეაქციები, რომლებიც იწვევს თავდაპირველ მოლეკულაში (სუბსტრატს) ერთი ატომის ან ატომების ჯგუფის შეცვლას სხვა ატომებით ან ატომების ჯგუფებით.
ჩანაცვლების რეაქციები მოიცავს გაჯერებულ და არომატულ ნაერთებს, როგორიცაა ალკანები, ციკლოალკანები ან არენები. მოდით მოვიყვანოთ ასეთი რეაქციების მაგალითები.
სინათლის გავლენით, წყალბადის ატომები მეთანის მოლეკულაში შეიძლება შეიცვალოს ჰალოგენის ატომებით, მაგალითად, ქლორის ატომებით:
წყალბადის ჰალოგენით ჩანაცვლების კიდევ ერთი მაგალითია ბენზოლის ბრომბენზოლად გადაქცევა:

ამ რეაქციის განტოლება შეიძლება სხვაგვარად დაიწეროს:
![]()
ჩაწერის ამ ფორმით, რეაგენტები, კატალიზატორი და რეაქციის პირობები იწერება ისრის ზემოთ, ხოლო არაორგანული რეაქციის პროდუქტები იწერება მის ქვემოთ.
რეაქციების შედეგად ორგანულ ნივთიერებებში ჩანაცვლება წარმოიქმნება არა მარტივი და რთული ნივთიერებები, როგორც არაორგანულ ქიმიაში და ორი რთული ნივთიერებები.
დანამატის რეაქციები
დანამატის რეაქციები- ეს არის რეაქციები, რის შედეგადაც მორეაქტიული ნივთიერებების ორი ან მეტი მოლეკულა ერთდება ერთში.
უჯერი ნაერთები, როგორიცაა ალკენები ან ალკინები, განიცდიან დამატებით რეაქციებს. იმისდა მიხედვით, თუ რომელი მოლეკულა მოქმედებს როგორც რეაგენტი, განასხვავებენ ჰიდროგენიზაციას (ან რედუქციას), ჰალოგენაციას, ჰიდროჰალოგენაციას, ჰიდრატაციას და სხვა დამატების რეაქციებს. თითოეული მათგანი მოითხოვს გარკვეულ პირობებს.
1.ჰიდროგენიზაცია- წყალბადის მოლეკულის დამატების რეაქცია მრავალჯერადი ბმის მეშვეობით:
2. ჰიდროჰალოგენაცია- წყალბადის ჰალოიდის დამატების რეაქცია (ჰიდროქლორირება):
3. ჰალოგენაცია- ჰალოგენის დამატების რეაქცია:
![]()
4.პოლიმერიზაცია- დამატების რეაქციის სპეციალური ტიპი, რომლის დროსაც მცირე მოლეკულური წონის ნივთიერების მოლეკულები ერწყმის ერთმანეთს და წარმოქმნის ძალიან მაღალი მოლეკულური წონის ნივთიერების მოლეკულებს - მაკრომოლეკულებს.
პოლიმერიზაციის რეაქციები არის დაბალი მოლეკულური წონის ნივთიერების (მონომერის) მრავალი მოლეკულის გაერთიანების პროცესი პოლიმერის დიდ მოლეკულებად (მაკრომოლეკულებად).
პოლიმერიზაციის რეაქციის მაგალითია პოლიეთილენის წარმოება ეთილენისგან (ეთენიდან) ულტრაიისფერი გამოსხივების მოქმედებით და რადიკალური პოლიმერიზაციის ინიციატორი R.
ორგანული ნაერთებისთვის ყველაზე დამახასიათებელი კოვალენტური ბმა იქმნება ატომური ორბიტალების გადახურვისას და საერთო ელექტრონული წყვილების წარმოქმნის დროს. ამის შედეგად წარმოიქმნება ორ ატომთან საერთო ორბიტალი, რომელშიც განლაგებულია საერთო ელექტრონული წყვილი. როდესაც ბმა იშლება, ამ საერთო ელექტრონების ბედი შეიძლება განსხვავებული იყოს.
რეაქტიული ნაწილაკების სახეები
ორბიტალი, რომელსაც აქვს დაუწყვილებელი ელექტრონი, რომელიც ეკუთვნის ერთ ატომს, შეიძლება გადაფაროს სხვა ატომის ორბიტალთან, რომელიც ასევე შეიცავს დაუწყვილებელ ელექტრონს. ამ შემთხვევაში, კოვალენტური ბმა იქმნება გაცვლის მექანიზმის მიხედვით:
კოვალენტური ბმის წარმოქმნის გაცვლის მექანიზმი რეალიზდება, თუ საერთო ელექტრონული წყვილი წარმოიქმნება სხვადასხვა ატომების კუთვნილი დაუწყვილებელი ელექტრონებისაგან.
გაცვლის მექანიზმით კოვალენტური ბმის წარმოქმნის საპირისპირო პროცესია ბმის გაწყვეტა, რომლის დროსაც თითო ელექტრონი იკარგება თითოეულ ატომში (). ამის შედეგად წარმოიქმნება ორი დაუმუხტი ნაწილაკი, რომლებსაც აქვთ დაუწყვილებელი ელექტრონები:
![]()
ასეთ ნაწილაკებს თავისუფალ რადიკალებს უწოდებენ.
თავისუფალი რადიკალები- ატომები ან ატომების ჯგუფები, რომლებსაც აქვთ დაუწყვილებელი ელექტრონები.
თავისუფალი რადიკალების რეაქციები- ეს არის რეაქციები, რომლებიც წარმოიქმნება თავისუფალი რადიკალების გავლენის ქვეშ და მონაწილეობით.
არაორგანული ქიმიის მსვლელობისას ეს არის წყალბადის რეაქციები ჟანგბადთან, ჰალოგენებთან და წვის რეაქციებით. ამ ტიპის რეაქციები ხასიათდება მაღალი სიჩქარით და დიდი რაოდენობით სითბოს გამოყოფით.
კოვალენტური ბმა ასევე შეიძლება ჩამოყალიბდეს დონორ-მიმღები მექანიზმით. ატომის (ან ანიონის) ერთ-ერთი ორბიტალი, რომელსაც აქვს მარტოხელა წყვილი ელექტრონები, გადაფარავს სხვა ატომის (ან კატიონის) დაუკავებელ ორბიტალს, რომელსაც აქვს დაუკავებელი ორბიტალი, და წარმოიქმნება კოვალენტური ბმა, მაგალითად:
![]()
კოვალენტური ბმის გაწყვეტა იწვევს დადებითად და უარყოფითად დამუხტული ნაწილაკების წარმოქმნას (); ვინაიდან ამ შემთხვევაში საერთო ელექტრონული წყვილის ორივე ელექტრონი რჩება ერთ-ერთ ატომთან, მეორე ატომს აქვს შეუვსებელი ორბიტალი:
![]()
განვიხილოთ მჟავების ელექტროლიტური დისოციაცია:
![]()
ადვილად მისახვედრია, რომ ნაწილაკი, რომელსაც აქვს ელექტრონების მარტოხელა წყვილი R: -, ანუ უარყოფითად დამუხტული იონი, მიიზიდავს დადებითად დამუხტულ ატომებს ან ატომებს, რომლებზეც არის მინიმუმ ნაწილობრივი ან ეფექტური დადებითი მუხტი.
ელექტრონების მარტოხელა წყვილის მქონე ნაწილაკებს ე.წ ნუკლეოფილური აგენტები (ბირთვი- "ბირთვი", ატომის დადებითად დამუხტული ნაწილი), ანუ ბირთვის "მეგობრები", დადებითი მუხტი.
ნუკლეოფილები(ნუ) - ანიონები ან მოლეკულები, რომლებსაც აქვთ ელექტრონების მარტოხელა წყვილი, რომლებიც ურთიერთქმედებენ მოლეკულების ნაწილებთან, რომლებსაც აქვთ ეფექტური დადებითი მუხტი.
ნუკლეოფილების მაგალითები: Cl - (ქლორიდის იონი), OH - (ჰიდროქსიდის ანიონი), CH 3 O - (მეთოქსიდის ანიონი), CH 3 COO - (აცეტატური ანიონი).
ნაწილაკები, რომლებსაც აქვთ შეუვსებელი ორბიტალი, პირიქით, მიდრეკილნი იქნებიან მის ავსებაში და, შესაბამისად, მიიზიდავენ მოლეკულების ნაწილებს, რომლებსაც აქვთ გაზრდილი ელექტრონის სიმკვრივე, უარყოფითი მუხტი და მარტოხელა ელექტრონული წყვილი. ისინი ელექტროფილები არიან, ელექტრონის „მეგობრები“, უარყოფითი მუხტი ან გაზრდილი ელექტრონის სიმკვრივის მქონე ნაწილაკები.
ელექტროფილები- კათიონები ან მოლეკულები, რომლებსაც აქვთ შეუვსებელი ელექტრონული ორბიტალი, რომლებიც მიდრეკილნი არიან შეავსონ იგი ელექტრონებით, რადგან ეს იწვევს ატომის უფრო ხელსაყრელ ელექტრონულ კონფიგურაციას.
არცერთი ნაწილაკი არ არის ელექტროფილი შეუვსებელი ორბიტალით. მაგალითად, ტუტე ლითონის კათიონებს აქვთ ინერტული აირების კონფიგურაცია და არ აქვთ ელექტრონების შეძენის ტენდენცია, რადგან მათ აქვთ დაბალი ელექტრონის აფინურობა.
აქედან შეგვიძლია დავასკვნათ, რომ შეუვსებელი ორბიტალის არსებობის მიუხედავად, ასეთი ნაწილაკები ელექტროფილები არ იქნება.
რეაქციის ძირითადი მექანიზმები
გამოვლენილია რეაქტიული ნაწილაკების სამი ძირითადი ტიპი - თავისუფალი რადიკალები, ელექტროფილები, ნუკლეოფილები - და რეაქციის მექანიზმების სამი შესაბამისი ტიპი:
- თავისუფალი რადიკალი;
- ელექტროფილური;
- ნულოფილური.
რეაქტიული ნაწილაკების ტიპის მიხედვით რეაქციების კლასიფიკაციის გარდა, ორგანულ ქიმიაში ოთხი ტიპის რეაქცია გამოირჩევა მოლეკულების შემადგენლობის შეცვლის პრინციპის მიხედვით: დამატება, ჩანაცვლება, გამოყოფა ან ელიმინაცია (ინგლისურიდან. რომ აღმოფხვრა- ამოღება, გაყოფა) და გადაწყობა. მას შემდეგ, რაც დამატება და ჩანაცვლება შეიძლება მოხდეს სამივე ტიპის რეაქტიული სახეობის გავლენის ქვეშ, შეიძლება გამოიყოს რამდენიმე მთავარირეაქციების მექანიზმები.


გარდა ამისა, განვიხილავთ ელიმინაციის რეაქციებს, რომლებიც წარმოიქმნება ნუკლეოფილური ნაწილაკების - ბაზების გავლენის ქვეშ.
6. აღმოფხვრა:
ალკენების (უჯერი ნახშირწყალბადების) გამორჩეული თვისებაა დამატების რეაქციების გატარების უნარი. ამ რეაქციების უმეტესობა მიმდინარეობს ელექტროფილური დამატების მექანიზმით.
ჰიდროჰალოგენაცია (ჰალოგენის დამატება წყალბადი):
როდესაც წყალბადის ჰალოგენი ემატება ალკენს წყალბადი ამატებს უფრო ჰიდროგენიზებულს ნახშირბადის ატომი, ანუ ატომი, რომელშიც მეტი ატომია წყალბადი და ჰალოგენი - ნაკლებად ჰიდროგენიზებულამდე.

 რეაქციების კლასიფიკაცია საწყისი და საბოლოო ნივთიერებების რაოდენობის მიხედვით: 1. დამატება 2. ელიმინაცია (ელიმინაცია) 3. ჩანაცვლება
რეაქციების კლასიფიკაცია საწყისი და საბოლოო ნივთიერებების რაოდენობის მიხედვით: 1. დამატება 2. ელიმინაცია (ელიმინაცია) 3. ჩანაცვლება
 რეაქციების კლასიფიკაცია ბმის გაწყვეტის მექანიზმის მიხედვით: 1. ჰომოლიზური (რადიკალური) რადიკალები 2. ჰეტეროლიზური (იონური) იონები.
რეაქციების კლასიფიკაცია ბმის გაწყვეტის მექანიზმის მიხედვით: 1. ჰომოლიზური (რადიკალური) რადიკალები 2. ჰეტეროლიზური (იონური) იონები.
 რეაქციის მექანიზმი მექანიზმი არის ქიმიური რეაქციის დეტალური აღწერა ეტაპობრივად, შუალედური პროდუქტებისა და ნაწილაკების მითითებით. რეაქციის სქემა: რეაქციის მექანიზმი:
რეაქციის მექანიზმი მექანიზმი არის ქიმიური რეაქციის დეტალური აღწერა ეტაპობრივად, შუალედური პროდუქტებისა და ნაწილაკების მითითებით. რეაქციის სქემა: რეაქციის მექანიზმი:
 რეაქციების კლასიფიკაცია რეაგენტების ტიპის მიხედვით 1. რადიკალი რადიკალი არის ქიმიურად აქტიური ნაწილაკი დაუწყვილებელი ელექტრონით. 2. ელექტროფილური ელექტროფილი არის ელექტრონის დეფიციტი ნაწილაკი ან მოლეკულა ელექტრონის დეფიციტის ატომით. 3. ნუკლეოფილური ნუკლეოფილი არის ანიონი ან ნეიტრალური მოლეკულა, რომელსაც აქვს ატომი მარტოხელა ელექტრონული წყვილით.
რეაქციების კლასიფიკაცია რეაგენტების ტიპის მიხედვით 1. რადიკალი რადიკალი არის ქიმიურად აქტიური ნაწილაკი დაუწყვილებელი ელექტრონით. 2. ელექტროფილური ელექტროფილი არის ელექტრონის დეფიციტი ნაწილაკი ან მოლეკულა ელექტრონის დეფიციტის ატომით. 3. ნუკლეოფილური ნუკლეოფილი არის ანიონი ან ნეიტრალური მოლეკულა, რომელსაც აქვს ატომი მარტოხელა ელექტრონული წყვილით.
 ქიმიური ბმების სახეები ორგანულ ნივთიერებებში ბმის ძირითადი ტიპია კოვალენტური (ნაკლებად გავრცელებული იონური) სიგმა ბმა (σ-): Pi ბმა (-)
ქიმიური ბმების სახეები ორგანულ ნივთიერებებში ბმის ძირითადი ტიპია კოვალენტური (ნაკლებად გავრცელებული იონური) სიგმა ბმა (σ-): Pi ბმა (-)
 ალკანები - ალიფატური (ცხიმოვანი) ნახშირწყალბადები "ალიფატოსი" - ზეთი, ცხიმი (ბერძნ.). Cn. H 2 n+2 გაჯერებული ნახშირწყალბადები
ალკანები - ალიფატური (ცხიმოვანი) ნახშირწყალბადები "ალიფატოსი" - ზეთი, ცხიმი (ბერძნ.). Cn. H 2 n+2 გაჯერებული ნახშირწყალბადები
 ჰომოლოგიური სერია: CH 4 - მეთანი C 2 H 6 - ეთანი C 3 H 8 - პროპან C 4 H 10 - ბუტანი C 5 H 12 - პენტანი და ა.შ. C 6 H 14 - ჰექსანი C 7 H 16 - ჰეპტანი C 8 H 18 - ოქტანი C 9 H 20 - ნონანი C 10 H 22 - დეკანი და C 390 H 782 - არაკონტრატრიტანი (1985)
ჰომოლოგიური სერია: CH 4 - მეთანი C 2 H 6 - ეთანი C 3 H 8 - პროპან C 4 H 10 - ბუტანი C 5 H 12 - პენტანი და ა.შ. C 6 H 14 - ჰექსანი C 7 H 16 - ჰეპტანი C 8 H 18 - ოქტანი C 9 H 20 - ნონანი C 10 H 22 - დეკანი და C 390 H 782 - არაკონტრატრიტანი (1985)

 მეთანის მოლეკულის ატომურ-ორბიტალური მოდელი მეთანის მოლეკულაში ნახშირბადის ატომს აღარ აქვს S- და P-ორბიტალები! მისი 4 ჰიბრიდული SP 3 ორბიტალი, თანაბარი ენერგიით და ფორმით, ქმნის 4 ბმას წყალბადის ატომის S ორბიტალებთან. H H 4 ბმები
მეთანის მოლეკულის ატომურ-ორბიტალური მოდელი მეთანის მოლეკულაში ნახშირბადის ატომს აღარ აქვს S- და P-ორბიტალები! მისი 4 ჰიბრიდული SP 3 ორბიტალი, თანაბარი ენერგიით და ფორმით, ქმნის 4 ბმას წყალბადის ატომის S ორბიტალებთან. H H 4 ბმები

 ნიტრაციული რეაქცია კონოვალოვი დიმიტრი პეტროვიჩი (1856 -1928) 1880 წ. პირველი წარმატებული მცდელობა "ქიმიური მკვდრების" გაცოცხლების, რომლებიც ითვლებოდა ალკანებად. მე ვიპოვე ალკანების ნიტრაციის პირობები. ბრინჯი. წყარო: http://images. Yandex. ru.
ნიტრაციული რეაქცია კონოვალოვი დიმიტრი პეტროვიჩი (1856 -1928) 1880 წ. პირველი წარმატებული მცდელობა "ქიმიური მკვდრების" გაცოცხლების, რომლებიც ითვლებოდა ალკანებად. მე ვიპოვე ალკანების ნიტრაციის პირობები. ბრინჯი. წყარო: http://images. Yandex. ru.
 ქიმიური თვისებები I. რეაქციები C-H ბმების რღვევასთან (ჩანაცვლების რეაქციები): 1. ჰალოგენაცია 2. ნიტრაცია 3. სულფოქლორირება II. რეაქციები C-C ბმების გაწყვეტით: 1. წვა 2. გაბზარვა 3. იზომერიზაცია
ქიმიური თვისებები I. რეაქციები C-H ბმების რღვევასთან (ჩანაცვლების რეაქციები): 1. ჰალოგენაცია 2. ნიტრაცია 3. სულფოქლორირება II. რეაქციები C-C ბმების გაწყვეტით: 1. წვა 2. გაბზარვა 3. იზომერიზაცია


 როგორ მოვძებნოთ ქიმიკოსი? თუ გინდა ქიმიკოსის პოვნა, ჰკითხე, რა არის ჩრჩილი და არაიონიზირებული. ხოლო თუ ბეწვიან ცხოველებზე და შრომის ორგანიზებაზე დაიწყებს საუბარს, მშვიდად წადით. სამეცნიერო ფანტასტიკის მწერალი, მეცნიერების პოპულარიზატორი ისააკ ასიმოვი (1920–1992) ნახ. წყარო: http://images. Yandex. ru.
როგორ მოვძებნოთ ქიმიკოსი? თუ გინდა ქიმიკოსის პოვნა, ჰკითხე, რა არის ჩრჩილი და არაიონიზირებული. ხოლო თუ ბეწვიან ცხოველებზე და შრომის ორგანიზებაზე დაიწყებს საუბარს, მშვიდად წადით. სამეცნიერო ფანტასტიკის მწერალი, მეცნიერების პოპულარიზატორი ისააკ ასიმოვი (1920–1992) ნახ. წყარო: http://images. Yandex. ru.
 1. ჰალოგენაციის რეაქცია ქლორირება: RH + Cl 2 hv RCl + HCl ბრომირება: RH + Br 2 hv RBr + HBr მაგალითად, მეთანის ქლორირება: CH 4 + Cl 2 CH 3 Cl + HCl
1. ჰალოგენაციის რეაქცია ქლორირება: RH + Cl 2 hv RCl + HCl ბრომირება: RH + Br 2 hv RBr + HBr მაგალითად, მეთანის ქლორირება: CH 4 + Cl 2 CH 3 Cl + HCl
 თავისუფალი რადიკალების მექანიზმის ეტაპები რეაქციის სქემა: CH 4 + Cl 2 CH 3 Cl + HCl რეაქციის მექანიზმი: I. ჯაჭვის დაწყება - თავისუფალი რადიკალების წარმოქმნის ეტაპი. Cl Cl 2 Cl რადიკალი არის აქტიური ნაწილაკი, რეაქციის ინიციატორი. – – სცენა მოითხოვს ენერგიას გათბობის ან განათების სახით. შემდგომი ეტაპები შეიძლება ჩატარდეს სიბნელეში, გათბობის გარეშე.
თავისუფალი რადიკალების მექანიზმის ეტაპები რეაქციის სქემა: CH 4 + Cl 2 CH 3 Cl + HCl რეაქციის მექანიზმი: I. ჯაჭვის დაწყება - თავისუფალი რადიკალების წარმოქმნის ეტაპი. Cl Cl 2 Cl რადიკალი არის აქტიური ნაწილაკი, რეაქციის ინიციატორი. – – სცენა მოითხოვს ენერგიას გათბობის ან განათების სახით. შემდგომი ეტაპები შეიძლება ჩატარდეს სიბნელეში, გათბობის გარეშე.
 თავისუფალი რადიკალების მექანიზმის ეტაპები II. ჯაჭვის ზრდა მთავარი ეტაპია. CH 4 + Cl HCl + CH 3 + Cl 2 CH 3 Cl + Cl სტადია შეიძლება მოიცავდეს რამდენიმე ქვესტადიას, რომელთაგან თითოეულში წარმოიქმნება ახალი რადიკალი, მაგრამ არა H!!! II ეტაპზე, მთავარ ეტაპზე, მთავარი პროდუქტი აუცილებლად ყალიბდება!
თავისუფალი რადიკალების მექანიზმის ეტაპები II. ჯაჭვის ზრდა მთავარი ეტაპია. CH 4 + Cl HCl + CH 3 + Cl 2 CH 3 Cl + Cl სტადია შეიძლება მოიცავდეს რამდენიმე ქვესტადიას, რომელთაგან თითოეულში წარმოიქმნება ახალი რადიკალი, მაგრამ არა H!!! II ეტაპზე, მთავარ ეტაპზე, მთავარი პროდუქტი აუცილებლად ყალიბდება!
 თავისუფალი რადიკალების მექანიზმის ეტაპები III. ჯაჭვის შეწყვეტა - რადიკალების რეკომბინაცია. Cl + Cl Cl 2 Cl + CH 3 CH 3 Cl CH 3 + CH 3 CH 3 -CH 3 ნებისმიერი ორი რადიკალი გაერთიანებულია.
თავისუფალი რადიკალების მექანიზმის ეტაპები III. ჯაჭვის შეწყვეტა - რადიკალების რეკომბინაცია. Cl + Cl Cl 2 Cl + CH 3 CH 3 Cl CH 3 + CH 3 CH 3 -CH 3 ნებისმიერი ორი რადიკალი გაერთიანებულია.
 ჩანაცვლების სელექციურობა სელექციურობა – სელექციურობა. რეგიოსელექტურობა არის სელექციურობა რეაქციების გარკვეულ არეალში. მაგალითად, ჰალოგენაციის სელექციურობა: 45% 3% დასკვნა? 55% 97%
ჩანაცვლების სელექციურობა სელექციურობა – სელექციურობა. რეგიოსელექტურობა არის სელექციურობა რეაქციების გარკვეულ არეალში. მაგალითად, ჰალოგენაციის სელექციურობა: 45% 3% დასკვნა? 55% 97%
 ჰალოგენაციის სელექციურობა დამოკიდებულია შემდეგ ფაქტორებზე: რეაქციის პირობები. დაბალ ტემპერატურაზე ის უფრო შერჩევითია. ჰალოგენის ბუნება. რაც უფრო აქტიურია ჰალოგენი, მით ნაკლებია შერჩევითი რეაქცია. F 2 რეაგირებს ძალიან ენერგიულად, C-C ობლიგაციების განადგურებით. I 2 არ რეაგირებს ალკანებთან ამ პირობებში. ალკანური სტრუქტურა.
ჰალოგენაციის სელექციურობა დამოკიდებულია შემდეგ ფაქტორებზე: რეაქციის პირობები. დაბალ ტემპერატურაზე ის უფრო შერჩევითია. ჰალოგენის ბუნება. რაც უფრო აქტიურია ჰალოგენი, მით ნაკლებია შერჩევითი რეაქცია. F 2 რეაგირებს ძალიან ენერგიულად, C-C ობლიგაციების განადგურებით. I 2 არ რეაგირებს ალკანებთან ამ პირობებში. ალკანური სტრუქტურა.
 ალკანის სტრუქტურის გავლენა ჩანაცვლების სელექციურობაზე. თუ ნახშირბადის ატომები ალკანში არათანაბარია, მაშინ თითოეული მათგანის ჩანაცვლება ხდება განსხვავებული სიჩქარით. ნათესავი ჩანაცვლების რეაქციის სიჩქარე პირველადი. H ატომი მეორადი ატომი H ტერტ. H ატომის ქლორირება 1 3, 9 5, 1 ბრომირება 1 82 1600 დასკვნა?
ალკანის სტრუქტურის გავლენა ჩანაცვლების სელექციურობაზე. თუ ნახშირბადის ატომები ალკანში არათანაბარია, მაშინ თითოეული მათგანის ჩანაცვლება ხდება განსხვავებული სიჩქარით. ნათესავი ჩანაცვლების რეაქციის სიჩქარე პირველადი. H ატომი მეორადი ატომი H ტერტ. H ატომის ქლორირება 1 3, 9 5, 1 ბრომირება 1 82 1600 დასკვნა?
 მესამეული წყალბადის ატომის ამოღებას ნაკლები ენერგია სჭირდება, ვიდრე მეორადი და პირველადი! ალკანის ფორმულა ჰომოლიზის შედეგი ED, kJ/mol CH 4 CH 3 + H 435 CH 3 - CH 3 C 2 H 5 + H 410 CH 3 CH 2 CH 3 (CH 3)2 CH + H 395 (CH 3)3 CH (CH 3)3 C + H 377
მესამეული წყალბადის ატომის ამოღებას ნაკლები ენერგია სჭირდება, ვიდრე მეორადი და პირველადი! ალკანის ფორმულა ჰომოლიზის შედეგი ED, kJ/mol CH 4 CH 3 + H 435 CH 3 - CH 3 C 2 H 5 + H 410 CH 3 CH 2 CH 3 (CH 3)2 CH + H 395 (CH 3)3 CH (CH 3)3 C + H 377
 რეაქციების მიმართულება ნებისმიერი რეაქცია უპირატესად მიმდინარეობს უფრო სტაბილური შუალედური ნაწილაკების წარმოქმნის მიმართულებით!
რეაქციების მიმართულება ნებისმიერი რეაქცია უპირატესად მიმდინარეობს უფრო სტაბილური შუალედური ნაწილაკების წარმოქმნის მიმართულებით!
 რადიკალურ რეაქციებში შუალედური ნაწილაკი თავისუფალი რადიკალია. ყველაზე სტაბილური რადიკალი ყველაზე მარტივად ყალიბდება! რადიკალების სტაბილურობის სერია: R 3 C > R 2 CH > RCH 2 > CH 3 ალკილის ჯგუფები ავლენენ ელექტრონის დონორ ეფექტს, რის გამოც ისინი ასტაბილურებენ რადიკალს
რადიკალურ რეაქციებში შუალედური ნაწილაკი თავისუფალი რადიკალია. ყველაზე სტაბილური რადიკალი ყველაზე მარტივად ყალიბდება! რადიკალების სტაბილურობის სერია: R 3 C > R 2 CH > RCH 2 > CH 3 ალკილის ჯგუფები ავლენენ ელექტრონის დონორ ეფექტს, რის გამოც ისინი ასტაბილურებენ რადიკალს
 სულფოქლორირების რეაქცია რეაქციის სქემა: RH + Cl 2 + SO 2 RSO 2 Cl + HCl რეაქციის მექანიზმი: 1. Cl Cl 2 Cl 2. RH + Cl R + HCl R + SO 2 RSO 2 + Cl 2 RSO 2 Cl + Cl და ა.შ. . და ა.შ. 3. 2 Cl Cl 2 და ა.შ.
სულფოქლორირების რეაქცია რეაქციის სქემა: RH + Cl 2 + SO 2 RSO 2 Cl + HCl რეაქციის მექანიზმი: 1. Cl Cl 2 Cl 2. RH + Cl R + HCl R + SO 2 RSO 2 + Cl 2 RSO 2 Cl + Cl და ა.შ. . და ა.შ. 3. 2 Cl Cl 2 და ა.შ.
 კონოვალოვის რეაქცია D.P. ნიტრაცია კონოვალოვის მიხედვით ხორციელდება განზავებული აზოტის მჟავას მოქმედებით 140 o ტემპერატურაზე. გ.რეაქციის სქემა: RH + HNO 3 RNO 2 + H 2 O
კონოვალოვის რეაქცია D.P. ნიტრაცია კონოვალოვის მიხედვით ხორციელდება განზავებული აზოტის მჟავას მოქმედებით 140 o ტემპერატურაზე. გ.რეაქციის სქემა: RH + HNO 3 RNO 2 + H 2 O
 კონოვალოვის რეაქციის მექანიზმი HNO 3 N 2 O 4 1. N 2 O 4 2 NO 2 2. RH + NO 2 R + HNO 2 R + HNO 3 RNO 2 + OH RH + OH R + H 2 O და ა.შ. 3 .გახსენით წრე.
კონოვალოვის რეაქციის მექანიზმი HNO 3 N 2 O 4 1. N 2 O 4 2 NO 2 2. RH + NO 2 R + HNO 2 R + HNO 3 RNO 2 + OH RH + OH R + H 2 O და ა.შ. 3 .გახსენით წრე.

 ალკენები არის უჯერი ნახშირწყალბადები ერთი C=C ბმით, Cn. H 2 n С=С – ალკენების ფუნქციური ჯგუფი
ალკენები არის უჯერი ნახშირწყალბადები ერთი C=C ბმით, Cn. H 2 n С=С – ალკენების ფუნქციური ჯგუფი



 ალკენების ქიმიური თვისებები ზოგადი მახასიათებლები ალკენები ნაერთების რეაქტიული კლასია. ისინი განიცდიან უამრავ რეაქციას, რომელთა უმეტესობა ხდება უფრო სუსტი პი ბმის გაწყვეტით. E C-C (σ-) ~ 350 კჯ/მოლი E C=C (-) ~ 260 კჯ/მოლი
ალკენების ქიმიური თვისებები ზოგადი მახასიათებლები ალკენები ნაერთების რეაქტიული კლასია. ისინი განიცდიან უამრავ რეაქციას, რომელთა უმეტესობა ხდება უფრო სუსტი პი ბმის გაწყვეტით. E C-C (σ-) ~ 350 კჯ/მოლი E C=C (-) ~ 260 კჯ/მოლი
 დამახასიათებელი რეაქციები დანამატი რეაქციის ყველაზე დამახასიათებელი ტიპია. ორმაგი ბმა არის ელექტრონის დონორი, ამიტომ ის მიდრეკილია დაამატოთ: E - ელექტროფილები, კატიონები ან რადიკალები.
დამახასიათებელი რეაქციები დანამატი რეაქციის ყველაზე დამახასიათებელი ტიპია. ორმაგი ბმა არის ელექტრონის დონორი, ამიტომ ის მიდრეკილია დაამატოთ: E - ელექტროფილები, კატიონები ან რადიკალები.
 ელექტროფილური დამატების რეაქციების მაგალითები 1. ჰალოგენების დამატება – ყველა ჰალოგენი არ ამატებს, მაგრამ მხოლოდ ქლორს და ბრომს! - ნეიტრალური ჰალოგენის მოლეკულის პოლარიზაცია შეიძლება მოხდეს პოლარული გამხსნელის ან ალკენის ორმაგი ბმის მოქმედებით. წითელ-ყავისფერი ბრომის ხსნარი ხდება უფერო
ელექტროფილური დამატების რეაქციების მაგალითები 1. ჰალოგენების დამატება – ყველა ჰალოგენი არ ამატებს, მაგრამ მხოლოდ ქლორს და ბრომს! - ნეიტრალური ჰალოგენის მოლეკულის პოლარიზაცია შეიძლება მოხდეს პოლარული გამხსნელის ან ალკენის ორმაგი ბმის მოქმედებით. წითელ-ყავისფერი ბრომის ხსნარი ხდება უფერო
 ელექტროფილური დანამატი რეაქციები ხდება ოთახის ტემპერატურაზე და არ საჭიროებს განათებას. მექანიზმი იონურია. რეაქციის სქემა: XY = Cl 2, Br 2, HCl, HBr, HI, H 2 O
ელექტროფილური დანამატი რეაქციები ხდება ოთახის ტემპერატურაზე და არ საჭიროებს განათებას. მექანიზმი იონურია. რეაქციის სქემა: XY = Cl 2, Br 2, HCl, HBr, HI, H 2 O

 სიგმა კომპლექსი არის კარბოკატიონი - ნახშირბადის ატომზე დადებითი მუხტის მქონე ნაწილაკი. თუ სხვა ანიონები იმყოფება რეაქციის გარემოში, მათ ასევე შეუძლიათ შეუერთდნენ კარბოკატიონს.
სიგმა კომპლექსი არის კარბოკატიონი - ნახშირბადის ატომზე დადებითი მუხტის მქონე ნაწილაკი. თუ სხვა ანიონები იმყოფება რეაქციის გარემოში, მათ ასევე შეუძლიათ შეუერთდნენ კარბოკატიონს.
 მაგალითად, წყალში გახსნილი ბრომის დამატება. ეს თვისებრივი რეაქცია ორმაგ C=C კავშირზე მიმდინარეობს ბრომის ხსნარის გაუფერულებით და ორი პროდუქტის წარმოქმნით:
მაგალითად, წყალში გახსნილი ბრომის დამატება. ეს თვისებრივი რეაქცია ორმაგ C=C კავშირზე მიმდინარეობს ბრომის ხსნარის გაუფერულებით და ორი პროდუქტის წარმოქმნით:


 დამატება არასიმეტრიულ ალკენებში დამატების რეგიოშერჩევითობა! მარკოვნიკოვის წესი (1869): მჟავები და წყალი ემატება არასიმეტრიულ ალკენებს ისე, რომ წყალბადი ემატება უფრო ჰიდროგენიზებულ ნახშირბადის ატომს.
დამატება არასიმეტრიულ ალკენებში დამატების რეგიოშერჩევითობა! მარკოვნიკოვის წესი (1869): მჟავები და წყალი ემატება არასიმეტრიულ ალკენებს ისე, რომ წყალბადი ემატება უფრო ჰიდროგენიზებულ ნახშირბადის ატომს.
 მარკოვნიკოვი ვლადიმერ ვასილიევიჩი (1837 - 1904) ყაზანის უნივერსიტეტის კურსდამთავრებული. 1869 წლიდან - ქიმიის განყოფილების პროფესორი. სამეცნიერო სკოლის დამფუძნებელი. ბრინჯი. წყარო: http://images. Yandex. ru.
მარკოვნიკოვი ვლადიმერ ვასილიევიჩი (1837 - 1904) ყაზანის უნივერსიტეტის კურსდამთავრებული. 1869 წლიდან - ქიმიის განყოფილების პროფესორი. სამეცნიერო სკოლის დამფუძნებელი. ბრინჯი. წყარო: http://images. Yandex. ru.
 მარკოვნიკოვის წესის ახსნა რეაქცია მიმდინარეობს ყველაზე სტაბილური შუალედური ნაწილაკის - კარბოკატიონის წარმოქმნით. პირველადი მეორადი, უფრო სტაბილური
მარკოვნიკოვის წესის ახსნა რეაქცია მიმდინარეობს ყველაზე სტაბილური შუალედური ნაწილაკის - კარბოკატიონის წარმოქმნით. პირველადი მეორადი, უფრო სტაბილური
 კარბოკაციონების სტაბილურობის სერია: მესამეული მეორადი პირველადი მეთილის მარკოვნიკოვის წესი თანამედროვე ფორმულირებაში: პროტონის დამატება ალკენში ხდება უფრო სტაბილური კარბოკაციონის წარმოქმნით.
კარბოკაციონების სტაბილურობის სერია: მესამეული მეორადი პირველადი მეთილის მარკოვნიკოვის წესი თანამედროვე ფორმულირებაში: პროტონის დამატება ალკენში ხდება უფრო სტაბილური კარბოკაციონის წარმოქმნით.

 ანტი-მარკოვნიკოვის დამატება CF 3 -CH=CH 2 + HBr CF 3 -CH 2 Br ფორმალურად, რეაქცია ეწინააღმდეგება მარკოვნიკოვის წესს. CF 3 – ელექტრონის ამომყვანი შემცვლელი სხვა ელექტრონის ამომყვანი აგენტები: NO 2, SO 3 H, COOH, ჰალოგენები და ა.შ.
ანტი-მარკოვნიკოვის დამატება CF 3 -CH=CH 2 + HBr CF 3 -CH 2 Br ფორმალურად, რეაქცია ეწინააღმდეგება მარკოვნიკოვის წესს. CF 3 – ელექტრონის ამომყვანი შემცვლელი სხვა ელექტრონის ამომყვანი აგენტები: NO 2, SO 3 H, COOH, ჰალოგენები და ა.შ.
 ანტი-მარკოვნიკოვის დანამატი უფრო სტაბილური არასტაბილური CF 3 - ელექტრონის მიმღები, ახდენს კარბოკატიონის დესტაბილიზაციას, რეაქცია მხოლოდ ფორმალურად ეწინააღმდეგება მარკოვნიკოვის წესს. ფაქტობრივად, ის ემორჩილება მას, ვინაიდან გადის უფრო სტაბილურ კარბოკატიონში.
ანტი-მარკოვნიკოვის დანამატი უფრო სტაბილური არასტაბილური CF 3 - ელექტრონის მიმღები, ახდენს კარბოკატიონის დესტაბილიზაციას, რეაქცია მხოლოდ ფორმალურად ეწინააღმდეგება მარკოვნიკოვის წესს. ფაქტობრივად, ის ემორჩილება მას, ვინაიდან გადის უფრო სტაბილურ კარბოკატიონში.
 ხარაშის პეროქსიდის ეფექტი X CH 3 -CH=CH 2 + HBr CH 3 -CH 2 Br X = O 2, H 2 O 2, ROOR თავისუფალი რადიკალების მექანიზმი: 1. H 2 O 2 2 OH + HBr H 2 O + Br 2 CH 3 -CH=CH 2 + Br CH 3 -CH -CH 2 Br უფრო სტაბილური რადიკალი CH 3 -CH -CH 2 Br + HBr CH 3 -CH 2 Br + Br და ა.შ. .
ხარაშის პეროქსიდის ეფექტი X CH 3 -CH=CH 2 + HBr CH 3 -CH 2 Br X = O 2, H 2 O 2, ROOR თავისუფალი რადიკალების მექანიზმი: 1. H 2 O 2 2 OH + HBr H 2 O + Br 2 CH 3 -CH=CH 2 + Br CH 3 -CH -CH 2 Br უფრო სტაბილური რადიკალი CH 3 -CH -CH 2 Br + HBr CH 3 -CH 2 Br + Br და ა.შ. .
 ელექტროფილური დანამატი 3. ჰიდრატაცია - წყლის დამატება - რეაქცია ხდება მჟავა კატალიზატორების, ყველაზე ხშირად გოგირდმჟავას არსებობისას. - რეაქცია ემორჩილება მარკოვნიკოვის წესს. ალკოჰოლის მიღების იაფი გზა
ელექტროფილური დანამატი 3. ჰიდრატაცია - წყლის დამატება - რეაქცია ხდება მჟავა კატალიზატორების, ყველაზე ხშირად გოგირდმჟავას არსებობისას. - რეაქცია ემორჩილება მარკოვნიკოვის წესს. ალკოჰოლის მიღების იაფი გზა
 გამოცდის დროს აკადემიკოსი ივან ალექსეევიჩ კაბალუკოვი სთხოვს სტუდენტს, უთხრას, როგორ წარმოიქმნება წყალბადი ლაბორატორიაში. "ვერცხლისწყლისგან," პასუხობს ის. "როგორ გულისხმობთ "ვერცხლისწყლისგან დამზადებული"? ! ისინი ჩვეულებრივ ამბობენ "თუთიისგან დამზადებული", მაგრამ ვერცხლისწყლისგან დამზადებული რაღაც ორიგინალურია. დაწერეთ რეაქცია." მოსწავლე წერს: Hg = H + g და ამბობს: „მერკური თბება; ის იშლება H და g-ად. H არის წყალბადი, ის მსუბუქია და ამიტომ მიფრინავს, მაგრამ g არის გრავიტაციის აჩქარება, მძიმე, რჩება. ”ასეთი პასუხისთვის თქვენ უნდა მიეცით A”, - ამბობს კაბალუკოვი. - ჩანაწერების წიგნი ავიღოთ. ჯერ "ხუთსაც" გავათბებ. "სამი" მიფრინავს, მაგრამ "ორი" რჩება."
გამოცდის დროს აკადემიკოსი ივან ალექსეევიჩ კაბალუკოვი სთხოვს სტუდენტს, უთხრას, როგორ წარმოიქმნება წყალბადი ლაბორატორიაში. "ვერცხლისწყლისგან," პასუხობს ის. "როგორ გულისხმობთ "ვერცხლისწყლისგან დამზადებული"? ! ისინი ჩვეულებრივ ამბობენ "თუთიისგან დამზადებული", მაგრამ ვერცხლისწყლისგან დამზადებული რაღაც ორიგინალურია. დაწერეთ რეაქცია." მოსწავლე წერს: Hg = H + g და ამბობს: „მერკური თბება; ის იშლება H და g-ად. H არის წყალბადი, ის მსუბუქია და ამიტომ მიფრინავს, მაგრამ g არის გრავიტაციის აჩქარება, მძიმე, რჩება. ”ასეთი პასუხისთვის თქვენ უნდა მიეცით A”, - ამბობს კაბალუკოვი. - ჩანაწერების წიგნი ავიღოთ. ჯერ "ხუთსაც" გავათბებ. "სამი" მიფრინავს, მაგრამ "ორი" რჩება."

 ორი ქიმიკოსი ლაბორატორიაში: - ვასია, ჩაავლე ხელი ამ ჭიქაში. - ჩავაგდე. -რამეს გრძნობ? - არა. - ასე რომ, სხვა ჭიქაში არის გოგირდის მჟავა.
ორი ქიმიკოსი ლაბორატორიაში: - ვასია, ჩაავლე ხელი ამ ჭიქაში. - ჩავაგდე. -რამეს გრძნობ? - არა. - ასე რომ, სხვა ჭიქაში არის გოგირდის მჟავა.
 არომატული ნახშირწყალბადები არომატული – სურნელოვანი? ? არომატული ნაერთები არის ბენზოლი და ნივთიერებები, რომლებიც მას ქიმიური ქცევით ჰგავს!
არომატული ნახშირწყალბადები არომატული – სურნელოვანი? ? არომატული ნაერთები არის ბენზოლი და ნივთიერებები, რომლებიც მას ქიმიური ქცევით ჰგავს!