Reaksiyalarning mexanizmi. Organik kimyoda reaksiya mexanizmlari qanday? Kimyoviy reaksiyalarning mexanizmlari bo‘yicha tasnifi
Noorganik va organik kimyoda kimyoviy reaksiyalarning turlari.
1. Kimyoviy reaksiya - bu bir moddadan boshqa moddalar hosil bo'ladigan jarayon. Jarayonning tabiatiga qarab, kimyoviy reaktsiyalarning turlari ajratiladi.
1) Yakuniy natijaga ko'ra
2) Issiqlikning chiqishi yoki yutilishiga asoslangan
3) Reaksiyaning teskariligiga asoslangan
4) Reaksiyaga kirishuvchi moddalarni tashkil etuvchi atomlarning oksidlanish darajasining o'zgarishiga asoslangan
Yakuniy natijaga ko'ra, reaktsiyalar quyidagi turlarga bo'linadi:
A) almashtirish: RH+Cl 2 →RCl+HCl
B) Qo‘shilish: CH 2 =CH 2 +Cl 2 →CH 2 Cl-CH 2 Cl
B) Eliminatsiya: CH 3 -CH 2 OH → CH 2 =CH 2 +H 2 O
D) Parchalanishi: CH 4 →C+2H 2
D) Izomerlanish
E) ayirboshlash
G) Ulanishlar
Parchalanish reaktsiyasi bir moddadan ikki yoki undan ortiq boshqa moddalar hosil bo'ladigan jarayondir.
Almashinuv reaktsiyasi reaksiyaga kirishuvchi moddalar o‘z tarkibiy qismlarini almashinadigan jarayondir.
Almashtirish reaksiyalari oddiy va murakkab moddalar ishtirokida yuzaga keladi, buning natijasida yangi oddiy va murakkab moddalar hosil bo'ladi.
Natijada birikma reaktsiyalari ikki yoki undan ortiq moddalardan bitta yangisi hosil bo'ladi.
Issiqlikning chiqishi yoki yutilishiga qarab, reaktsiyalar quyidagi turlarga bo'linadi:
A) Ekzotermik
B) Endotermik
Ekzotermik - Bu issiqlik chiqishi bilan sodir bo'ladigan reaktsiyalar.
Endotermik- Bular atrof-muhitdan issiqlikni yutish bilan sodir bo'ladigan reaktsiyalardir.
Qaytarilish qobiliyatiga ko'ra reaktsiyalar quyidagi turlarga bo'linadi:
A) Qaytariladigan
B) Qaytarib bo‘lmaydigan
Faqat bir yo'nalishda davom etadigan va boshlang'ich reaktivlarning yakuniy moddalarga to'liq aylanishi bilan yakunlanadigan reaksiyalar deyiladi. qaytarilmas.
Qaytariladigan Bir vaqtning o'zida ikkita qarama-qarshi yo'nalishda sodir bo'ladigan reaktsiyalar deyiladi.
Reaksiyaga kiruvchi moddalarni tashkil etuvchi atomlarning oksidlanish darajasidagi o‘zgarishlarga asoslanib, reaksiyalar quyidagi turlarga bo‘linadi:
A) Oksidlanish-qaytarilish
Atomlarning oksidlanish darajasining o'zgarishi bilan sodir bo'ladigan reaktsiyalar (bunda elektronlar bir atomdan, molekuladan yoki iondan boshqasiga o'tadi) deyiladi. redoks.
2. Reaktsiya mexanizmiga ko'ra reaktsiyalar ionli va radikallarga bo'linadi.
Ion reaktsiyalari- kimyoviy bog'lanishning geterolitik yorilishi natijasida ionlar orasidagi o'zaro ta'sir (bir juft elektron butunlay "parchalar" dan biriga o'tadi).
Ion reaktsiyalari ikki xil (reagent turiga qarab):
A) elektrofil - elektrofil bilan reaksiya jarayonida.
Elektrofil- ba'zi atomlarda elektron zichligi kamaygan erkin orbitallar yoki markazlarga ega bo'lgan guruh (masalan: H +, Cl - yoki AlCl 3)
B) Nukleofil - nukleofil bilan o'zaro ta'sir qilishda
Nukleofil - manfiy zaryadlangan ion yoki molekula yolgʻiz elektron jufti (hozirda kimyoviy bogʻlanish hosil boʻlishida ishtirok etmaydi).
(Misollar: F - , Cl - , RO - , I -).
Haqiqiy kimyoviy jarayonlarni kamdan-kam hollarda oddiy mexanizmlar bilan tasvirlash mumkin. Kimyoviy jarayonlarni molekulyar kinetik nuqtai nazardan batafsil o'rganish shuni ko'rsatadiki, ularning aksariyati radikal zanjir mexanizmi bo'ylab boradi; zanjir reaktsiyalarining o'ziga xos xususiyati oraliq bosqichlarda erkin radikallarning hosil bo'lishidir (molekulalar yoki atomlarning beqaror bo'laklari qisqa umr ko'rish). , barchasida bepul aloqa mavjud.
Tirik organizmlarda yonish, portlash, oksidlanish, fotokimyoviy reaksiyalar va biokimyoviy reaksiyalar zanjirli mexanizm orqali boradi.
Zanjir tizimlari bir necha bosqichlardan iborat:
1) zanjir yadrolanishi - zanjir reaktsiyalarining bosqichi, buning natijasida valentlik bilan to'yingan molekulalardan erkin radikallar paydo bo'ladi.
2) zanjirning davomi - bo'sh bosqichlarning umumiy sonini saqlab qolgan holda davom etuvchi zanjirning bosqichi.
3) zanjir uzilishi - erkin bog'lanishlarning yo'qolishiga olib keladigan jarayonlar zanjirining elementar bosqichi.
Tarmoqlangan va tarmoqlanmagan zanjirli reaksiyalar mavjud.
Zanjirning eng muhim tushunchalaridan biri zanjir uzunligi- erkin radikal paydo bo'lgandan keyin uning yo'qolguniga qadar zanjir davom etishining elementar bosqichlarining o'rtacha soni.
Misol: vodorod xlorid sintezi
1) CL 2 energiya kvantini yutadi va radikal 2 tasviri: CL 2 +hv=CL * +CL *
2) faol zarracha m-molekula H 2 bilan birikib, vodorod xlorid va H 2 faol zarrachani hosil qiladi: CL 1 + H 2 = HCL + H *
3)CL 1 +H 2 =HCL+CL * va hokazo.
6)H * +CL * =HCL - ochiq tutashuv.
Tarmoqlangan mexanizm:
F * +H 2 =HF+H * va boshqalar.
F * +H 2 =HF+H * va boshqalar.
Suvda u murakkabroq - OH*, O* radikallari va H* radikallari hosil bo'ladi.
Ionlashtiruvchi nurlanish ta'sirida sodir bo'ladigan reaktsiyalar: rentgen nurlari, katod nurlari va boshqalar - radiokimyoviy deb ataladi.
Molekulalarning nurlanish bilan o'zaro ta'siri natijasida molekulalarning parchalanishi eng reaktiv zarrachalar hosil bo'lishi bilan kuzatiladi.
Bunday reaktsiyalar zarrachalarning rekombinatsiyasiga va ularning turli xil birikmalari bilan moddalar hosil bo'lishiga yordam beradi.
Bunga misol sifatida gidrazin N 2 H 4 - raketa yoqilg'isining tarkibiy qismidir. So'nggi paytlarda g-nurlari ta'sirida ammiakdan gidrazin olishga urinishlar qilindi:
NH 3 → NH 2 * + H*
2NH 2 *→ N 2 H 4
Radiokimyoviy reaktsiyalar, masalan, suvning radiolizi, organizmlar hayoti uchun muhimdir.
Adabiyot:
1. Axmetov, N.S. Umumiy va noorganik kimyo / N.S. Axmetov. – 3-nashr. – M.: Oliy maktab, 2000. – 743 b.
- Korovin N.V. Umumiy kimyo / N.V. Korovin. – M.: Oliy maktab, 2006. – 557 b.
- Kuzmenko N.E. Kimyo bo'yicha qisqa kurs / N.E. Kuzmenko, V.V.Eremin, V.A. Popkov. – M.: Oliy maktab, 2002. – 415 b.
- Zaitsev, O.S. Umumiy kimyo. Moddalarning tuzilishi va kimyoviy reaktsiyalar / O.S. Zaitsev. – M.: Kimyo, 1990 yil.
- Karapetyants, M.X. Moddaning tuzilishi / M.X. Karapetyants, S.I.Drakin. - M.: Oliy maktab, 1981 yil.
- Paxta F. Noorganik kimyo asoslari / F. Cotton, J. Wilkinson. – M.: Mir, 1981 yil.
- Ugay, Ya.A. Umumiy va noorganik kimyo / Ya.A.Ugai. – M.: Oliy maktab, 1997 yil.
Organik reaksiyalar mexanizmlari
| Parametr nomi | Ma'nosi |
| Maqola mavzusi: | Organik reaksiyalar mexanizmlari |
| Rubrika (tematik toifa) | Ta'lim |
Reaksiyalarning tasnifi
Organik birikmalar ishtirok etadigan reaktsiyalarning to'rtta asosiy turi mavjud: almashtirish (o'zgartirish), qo'shish, yo'q qilish (eliminatsiya), qayta tashkil etish.
3.1 Almashtirish reaksiyalari
Reaksiyaning birinchi turida almashtirish odatda uglerod atomida sodir bo'ladi, lekin almashtirilgan atom vodorod atomi yoki boshqa atom yoki atomlar guruhi bo'lishi kerak. Elektrofil almashtirish vaqtida vodorod atomi ko'pincha almashtiriladi; Bunga klassik aromatik almashtirish misol bo'ladi:
Nukleofil almashtirish bilan, ko'pincha vodorod atomi emas, balki boshqa atomlar almashtiriladi, masalan:
NC - + R−Br → NC−R +BR -
3.2 Qo'shilish reaktsiyalari
Qo'shilish reaktsiyalari jarayonni boshlagan turlarning turiga qarab elektrofil, nukleofil yoki radikal bo'lishi mumkin. Oddiy uglerod-uglerodli qo'sh aloqalarga ulanish odatda elektrofil yoki radikal tomonidan qo'zg'atiladi. Masalan, HBr qo'shilishi
qo'sh bog'lanishning H+ proton yoki Br· radikalining hujumi bilan boshlanishi mumkin.
3.3 Eliminatsiya reaktsiyalari
Eliminatsiya reaktsiyalari asosan qo'shilish reaktsiyalarining teskarisidir; Bunday reaksiyaning eng keng tarqalgan turi alkenlarni hosil qilish uchun qo'shni uglerod atomlaridan vodorod atomi va boshqa atom yoki guruhni yo'q qilishdir:
3.4 Qayta tartibga solish reaksiyalari
Qayta tuzilishlar kationlar, anionlar yoki radikallar bo'lgan oraliq birikmalar orqali ham sodir bo'lishi mumkin; Ko'pincha, bu reaktsiyalar karbokationlar yoki boshqa elektron etishmaydigan zarrachalar hosil bo'lishi bilan sodir bo'ladi. Qayta tartibga solish uglerod skeletini sezilarli darajada qayta qurishni o'z ichiga olishi mumkin. Bunday reaktsiyalarda qayta tashkil etish bosqichining o'zi ko'pincha almashtirish, qo'shish yoki yo'q qilish bosqichlari bilan davom etadi va bu barqaror yakuniy mahsulot hosil bo'lishiga olib keladi.
Kimyoviy reaktsiyaning bosqichlar bo'yicha batafsil tavsifi odatda mexanizm deb ataladi. Elektron nuqtai nazardan, kimyoviy reaksiya mexanizmi deganda molekulalardagi kovalent bog'lanishlarni uzish usuli va reaksiyaga kirishuvchi moddalar reaksiya mahsulotiga aylanishdan oldin o'tadigan holatlar ketma-ketligi tushuniladi.
4.1 Erkin radikal reaksiyalar
Erkin radikal reaktsiyalar - bu juftlashtirilmagan elektronlari bo'lgan molekulalar ishtirok etadigan kimyoviy jarayonlar. Erkin radikal reaktsiyalarning ba'zi jihatlari boshqa turdagi reaktsiyalarga nisbatan o'ziga xosdir. Asosiy farq shundaki, ko'plab erkin radikal reaktsiyalar zanjirli reaktsiyalardir. Bu shuni anglatadiki, bitta reaktiv turning yaratilishi bilan boshlangan takroriy jarayon orqali ko'plab molekulalar mahsulotga aylanadigan mexanizm mavjud. Oddiy misol quyidagi gipotetik mexanizm yordamida tasvirlangan:
Reaksiya oraliq mahsuloti, bu holda A · hosil bo'ladigan bosqich odatda boshlash deb ataladi. Bu bosqich yuqori haroratlarda, UV yoki peroksidlar ta'sirida, qutbsiz erituvchilarda sodir bo'ladi. Ushbu misoldagi keyingi to'rtta tenglama ikkita reaktsiyaning ketma-ketligini takrorlaydi; ular zanjirning rivojlanish bosqichini ifodalaydi. Zanjirli reaktsiyalar zanjirning uzunligi bilan tavsiflanadi, bu boshlanish bosqichidagi rivojlanish bosqichlari soniga to'g'ri keladi. Ikkinchi bosqich birikmaning bir vaqtning o'zida sintezi va transformatsiyalar zanjirini davom ettiradigan yangi radikal hosil bo'lishi bilan sodir bo'ladi. Oxirgi bosqich zanjirni tugatish bosqichi bo'lib, unda zanjir rivojlanishi uchun zarur bo'lgan reaktsiya oraliq moddalaridan biri yo'q qilingan har qanday reaktsiya kiradi. Zanjirni tugatish bosqichlari qanchalik ko'p bo'lsa, zanjir uzunligi shunchalik qisqaroq bo'ladi.
Erkin radikal reaksiyalar: 1) yorug'likda, yuqori haroratda yoki boshqa moddalarning parchalanishida hosil bo'ladigan radikallar ishtirokida; 2) erkin radikallar bilan oson reaksiyaga kirishadigan moddalar tomonidan inhibe qilinadi; 3) qutbsiz erituvchilarda yoki bug 'fazasida paydo bo'ladi; 4) reaksiya boshlanishidan oldin ko'pincha avtokatalitik va induksiya davriga ega; 5) kinetik jihatdan ular zanjirli.
Alkanlar uchun radikal almashinish reaksiyalari, alkenlar va alkinlar uchun esa radikal qoʻshilish reaksiyalari xarakterlidir.
CH 4 + Cl 2 → CH 3 Cl + HCl
CH 3 -CH=CH 2 + HBr → CH 3 -CH 2 -CH 2 Br
CH 3 -C≡CH + HCl → CH 3 -CH=CHCl
Erkin radikallarning bir-biri bilan bog'lanishi va zanjirning uzilishi asosan reaktor devorlarida sodir bo'ladi.
4.2 Ion reaksiyalari
U sodir bo'ladigan reaktsiyalar geterolitik bog'larning uzilishi va ion tipidagi oraliq zarrachalarning hosil bo'lishi ion reaksiyalari deyiladi.
Ion reaktsiyalari: 1) katalizatorlar ishtirokida (kislotalar yoki asoslar va yorug'lik yoki erkin radikallar ta'sir qilmaydi, xususan, peroksidlarning parchalanishidan kelib chiqadigan); 2) erkin radikallarni tozalash vositalaridan ta'sirlanmaydi; 3) erituvchining tabiati reaksiyaning borishiga ta'sir qiladi; 4) bug 'fazasida kamdan-kam uchraydi; 5) kinetik jihatdan ular asosan birinchi yoki ikkinchi tartibli reaksiyalardir.
Molekulaga ta'sir qiluvchi reaktivning tabiatiga ko'ra ion reaktsiyalari quyidagilarga bo'linadi. elektrofil Va nukleofil. Nukleofil almashinish reaksiyalari alkil va arilgalogenidlarga xosdir.
CH 3 Cl + H 2 O → CH 3 OH + HCl
C 6 H 5 -Cl + H 2 O → C 6 H 5 -OH + HCl
C 2 H 5 OH + HCl → C 2 H 5 Cl + H 2 O
C 2 H 5 NH 2 + CH 3 Cl → CH 3 -NH-C 2 H 5 + HCl
elektrofil almashtirish - katalizatorlar ishtirokida alkanlar uchun
CH 3 -CH 2 -CH 2 -CH 2 -CH 3 → CH 3 -CH(CH 3)-CH 2 -CH 3
va arenalar.
C 6 H 6 + HNO 3 + H 2 SO 4 → C 6 H 5 -NO 2 + H 2 O
Alkenlarga elektrofil qo'shilish reaksiyalari xosdir
CH 3 -CH=CH 2 + Br 2 → CH 3 -CHBr-CH 2 Br
va alkinlar,
CH≡CH + Cl 2 → CHCl=CHCl
nukleofil qo'shilish - alkinlar uchun.
CH 3 -C≡CH + C 2 H 5 OH + NaOH → CH 3 -C(OC 2 H 5) = CH 2
Organik reaksiyalar mexanizmlari - tushunchasi va turlari. "Organik reaksiyalar mexanizmlari" toifasi tasnifi va xususiyatlari 2017, 2018 yil.
CH 3 -CH 3 + Cl 2 – (hv) ---- CH 3 -CH 2 Cl + HCl
C 6 H 5 CH 3 + Cl 2 --- 500 C --- C 6 H 5 CH 2 Cl + HCl
Qo'shilish reaktsiyalari
Bunday reaktsiyalar ko'p (ikki yoki uch) bog'langan organik birikmalar uchun xosdir. Ushbu turdagi reaksiyalarga alken va alkinlarga galogenlar, vodorod galoidlari va suvning qo'shilishi reaktsiyalari kiradi.
CH 3 -CH=CH 2 + HCl ---- CH 3 -CH(Cl)-CH 3
Eliminatsiya reaktsiyalari
Bular bir nechta bog'lanishlarning shakllanishiga olib keladigan reaktsiyalardir. Vodorod galogenidlari va suvni yo'q qilishda Zaitsev qoidasi bilan tavsiflangan reaktsiyaning ma'lum bir selektivligi kuzatiladi, unga ko'ra vodorod atomlari kamroq bo'lgan uglerod atomidan vodorod atomi chiqariladi. Misol reaktsiyasi
CH3-CH(Cl)-CH 2 -CH 3 + KOH →CH 3 -CH=CH-CH 3 + HCl
Polimerizatsiya va polikondensatsiya
n(CH 2 =CHCl) (-CH 2 -CHCl)n
Redoks
Oksidlanish reaktsiyalarining eng kuchlisi yonishdir, bu organik birikmalarning barcha sinflariga xos bo'lgan reaktsiya. Bunda yonish sharoitiga qarab uglerod C (soot), CO yoki CO 2 ga oksidlanadi, vodorod esa suvga aylanadi. Biroq, organik kimyogarlar uchun yonishdan ko'ra ancha yumshoq sharoitlarda amalga oshiriladigan oksidlanish reaktsiyalari katta qiziqish uyg'otadi. Qo'llaniladigan oksidlovchi moddalar: Br2 ning suvdagi yoki CCl 4dagi Cl2 eritmalari; KMnO 4 suvda yoki suyultirilgan kislotada; mis oksidi; yangi cho'kma kumush (I) yoki mis (II) gidroksidlari.
3C 2 H 2 + 8KMnO 4 +4H 2 O→3HOOC-COOH + 8MnO 2 + 8KOH
Esterifikatsiya (va uning teskari gidroliz reaktsiyasi)
R 1 COOH + HOR 2 H+ R 1 COOR 2 + H 2 O
Cycloaddition
Y R Y-R
‖ + ‖ → ǀ ǀ
R Y R-Y
‖ + →
11. Mexanizmi bo'yicha organik reaksiyalarning tasnifi. Misollar.
Reaktsiya mexanizmi kimyoviy reaktsiyalarning batafsil tavsifini o'z ichiga oladi. Shu bilan birga, qanday kovalent bog'lanishlar, qanday tartibda va qanday tarzda uzilganligi aniqlanadi. Reaksiya jarayonida yangi bog'larning hosil bo'lishi ham diqqat bilan tasvirlangan. Reaktsiya mexanizmini ko'rib chiqishda, birinchi navbatda, reaksiyaga kirishuvchi molekulada kovalent bog'lanishning uzilish usuliga e'tibor bering. Bunday ikkita yo'l bor - homolitik va geterolitik.
Radikal reaktsiyalar kovalent bog'lanishning gomolitik (radikal) bo'linishi bilan davom eting:

Qutbsiz yoki past qutbli kovalent aloqalar (C–C, N–N, C–H) yuqori haroratda yoki yorugʻlik taʼsirida radikal parchalanishga uchraydi. CH 3 radikalidagi uglerod 7 ta tashqi elektronga ega (CH 4 da barqaror oktet qobig'i o'rniga). Radikallar beqaror, ular etishmayotgan elektronni ushlashga moyildirlar (juft yoki oktetgacha). Barqaror mahsulotlarni shakllantirish usullaridan biri bu dimerizatsiya (ikki radikalning kombinatsiyasi):
CH 3 + CH 3 CH 3 : CH 3,
N + N N : N.
Radikal reaktsiyalar - Bular, masalan, alkanlarni xlorlash, bromlash va nitrlash reaksiyalari:

Ion reaktsiyalari geterolitik bog'lanishning parchalanishi bilan sodir bo'ladi. Bunda oraliq uglerod atomida zaryadga ega bo'lgan qisqa muddatli organik ionlar - karbokationlar va karbanionlar hosil bo'ladi. Ion reaktsiyalarida bog'lovchi elektron jufti ajratilmaydi, balki butunlay atomlardan biriga o'tib, uni anionga aylantiradi:

Kuchli qutbli (H–O, C–O) va oson qutblanuvchi (C–Br, C–I) bogʻlanishlar geterolitik boʻlinishga moyil.
Farqlash nukleofil reaktsiyalar (nukleofil– yadro izlash, elektronlar yetishmaydigan joy) va elektrofil reaktsiyalar (elektrofil- elektronlarni qidirish). Muayyan reaksiyaning nukleofil yoki elektrofil ekanligi haqidagi bayonot har doim reaktivga tegishli. Reaktiv- oddiyroq tuzilishga ega bo'lgan reaktsiyada ishtirok etuvchi modda. Substrat- murakkabroq tuzilishga ega bo'lgan boshlang'ich modda. Chiqish guruhi uglerod bilan bog'langan almashtiriladigan iondir. Reaktsiya mahsuloti– yangi uglerod o'z ichiga olgan modda (reaksiya tenglamasining o'ng tomonida yozilgan).
TO nukleofil reagentlar(nukleofillar) manfiy zaryadlangan ionlar, yolgʻiz juft elektronli birikmalar, qoʻsh uglerod-uglerod bogʻli birikmalar kiradi. TO elektrofil reagentlar(elektrofillar)ga musbat zaryadlangan ionlar, toʻldirilmagan elektron qobiqli birikmalar (AlCl 3, BF 3, FeCl 3), karbonil guruhlari boʻlgan birikmalar, galogenlar kiradi. Elektrofillar har qanday atom, molekula yoki yangi bog'lanish jarayonida bir juft elektron qo'shishga qodir bo'lgan iondir. Ion reaktsiyalarining harakatlantiruvchi kuchi qarama-qarshi zaryadlangan ionlarning yoki turli molekulalarning qisman zaryadli (+ va -) bo'laklarining o'zaro ta'siridir.
Organik moddalarning reaktsiyalarini rasmiy ravishda to'rtta asosiy turga bo'lish mumkin: almashtirish, qo'shish, yo'q qilish (eliminatsiya) va qayta tartibga solish (izomerizatsiya). Ko'rinib turibdiki, organik birikmalarning barcha reaktsiyalarini taklif qilingan tasnifga (masalan, yonish reaktsiyalari) qisqartirish mumkin emas. Biroq, bunday tasnif sizga allaqachon tanish bo'lgan noorganik moddalar o'rtasida yuzaga keladigan reaktsiyalar bilan o'xshashlikni o'rnatishga yordam beradi.
Odatda, reaksiyada ishtirok etadigan asosiy organik birikma deyiladi substrat, va boshqa reaksiya komponenti shartli ravishda hisoblanadi reaktiv.
Almashtirish reaksiyalari
Almashtirish reaksiyalari- bu asl molekulada (substratda) bitta atom yoki atomlar guruhini boshqa atomlar yoki atomlar guruhlari bilan almashtirishga olib keladigan reaktsiyalar.
O'zgartirish reaktsiyalari alkanlar, sikloalkanlar yoki arenlar kabi to'yingan va aromatik birikmalarni o'z ichiga oladi. Keling, bunday reaktsiyalarga misollar keltiraylik.
Yorug'lik ta'sirida metan molekulasidagi vodorod atomlari halogen atomlari bilan almashtirilishi mumkin, masalan, xlor atomlari:
Vodorodni galogen bilan almashtirishning yana bir misoli benzolning bromobenzolga aylanishidir:

Ushbu reaksiya tenglamasini boshqacha yozish mumkin:
![]()
Ushbu yozuv shaklida reaktivlar, katalizatorlar va reaksiya sharoitlari strelka tepasida, noorganik reaksiya mahsulotlari esa uning ostida yoziladi.
Reaksiyalar natijasida organik moddalardagi almashtirishlar oddiy va murakkab bo'lmagan holda hosil bo'ladi moddalar, noorganik kimyodagi kabi va ikkita murakkab moddalar.
Qo'shilish reaktsiyalari
Qo'shilish reaktsiyalari- bu reaksiyalar bo'lib, natijada reaksiyaga kirishuvchi moddalarning ikki yoki undan ortiq molekulalari bittaga birlashadi.
Alkenlar yoki alkinlar kabi to'yinmagan birikmalar qo'shilish reaktsiyalariga uchraydi. Qaysi molekula reagent vazifasini bajarishiga qarab gidrogenlanish (yoki qaytarilish), galogenlash, gidrogalogenlash, gidratlanish va boshqa qo‘shilish reaksiyalari farqlanadi. Ularning har biri ma'lum shartlarni talab qiladi.
1.Gidrogenlash- vodorod molekulasining ko'p bog'lanish orqali qo'shilishi reaktsiyasi:
2. Gidrogalogenlash- galogen vodorod qo'shilish reaktsiyasi (gidroklorlash):
3. Galogenlash- halogen qo'shilish reaktsiyasi:
![]()
4.Polimerizatsiya- kichik molekulyar og'irlikdagi moddaning molekulalari bir-biri bilan qo'shilib, juda yuqori molekulyar og'irlikdagi moddaning molekulalarini - makromolekulalarni hosil qiladigan qo'shilish reaktsiyasining maxsus turi.
Polimerlanish reaktsiyalari - past molekulyar og'irlikdagi moddaning (monomer) ko'plab molekulalarini polimerning yirik molekulalariga (makromolekulyarlariga) birlashtirish jarayonlari.
Polimerlanish reaksiyasiga ultrabinafsha nurlanish taʼsirida etilendan (eten) polietilen olish va radikal polimerlanish inisiatori R.
Organik birikmalar uchun eng xarakterli kovalent bog'lanish atom orbitallari bir-birining ustiga chiqishi va umumiy elektron juftlari hosil bo'lishi natijasida hosil bo'ladi. Buning natijasida ikkita atom uchun umumiy orbital hosil bo'lib, unda umumiy elektron jufti joylashgan. Bog'lanish buzilganda, bu umumiy elektronlarning taqdiri boshqacha bo'lishi mumkin.
Reaktiv zarrachalarning turlari
Bir atomga tegishli bo'lgan juftlashtirilmagan elektronga ega bo'lgan orbital boshqa atomning orbitali bilan qoplanishi mumkin, unda juftlashtirilmagan elektron ham mavjud. Bunday holda, kovalent bog'lanish almashinuv mexanizmiga muvofiq hosil bo'ladi:
Kovalent bog'lanishning almashinish mexanizmi, agar turli atomlarga tegishli bo'lmagan elektronlardan umumiy elektron juft hosil bo'lsa, amalga oshiriladi.
Almashinuv mexanizmi bilan kovalent bog'lanish hosil bo'lishiga qarama-qarshi jarayon bog'lanishning ajralishi bo'lib, unda har bir atomga bitta elektron yo'qoladi (). Natijada, juftlashtirilmagan elektronlarga ega bo'lgan ikkita zaryadsiz zarracha hosil bo'ladi:
![]()
Bunday zarralar erkin radikallar deb ataladi.
Erkin radikallar- juftlanmagan elektronlarga ega bo'lgan atomlar yoki atomlar guruhlari.
Erkin radikal reaktsiyalar- bu erkin radikallar ta'sirida va ishtirokida sodir bo'ladigan reaktsiyalar.
Noorganik kimyo kursida bular vodorodning kislorod, galogenlar bilan reaksiyalari va yonish reaksiyalaridir. Ushbu turdagi reaktsiyalar yuqori tezlik va katta miqdorda issiqlik chiqishi bilan tavsiflanadi.
Kovalent bog'lanish donor-akseptor mexanizmi orqali ham hosil bo'lishi mumkin. Yagona juft elektronga ega boʻlgan atomning (yoki anionning) orbitallaridan biri band boʻlmagan orbitalga ega boʻlgan boshqa atomning (yoki kationning) band boʻlmagan orbitali bilan ustma-ust tushadi va kovalent bogʻ hosil boʻladi, masalan:
![]()
Kovalent bog'lanishning yorilishi musbat va manfiy zaryadlangan zarrachalarning paydo bo'lishiga olib keladi (); chunki bu holda umumiy elektron juftlikdagi ikkala elektron atomlardan birida qoladi, boshqa atom to'ldirilmagan orbitalga ega:
![]()
Keling, kislotalarning elektrolitik dissotsiatsiyasini ko'rib chiqaylik:
![]()
Osonlik bilan taxmin qilish mumkinki, bitta juft elektron R: -, ya'ni manfiy zaryadlangan ionga ega bo'lgan zarracha musbat zaryadlangan atomlarga yoki hech bo'lmaganda qisman yoki samarali musbat zaryadga ega bo'lgan atomlarga tortiladi.
Yagona juft elektronli zarralar deyiladi nukleofil moddalar (yadro- "yadro", atomning musbat zaryadlangan qismi), ya'ni yadroning "do'stlari", musbat zaryad.
Nukleofillar(Nu) - samarali musbat zaryadga ega bo'lgan molekulalarning qismlari bilan o'zaro ta'sir qiluvchi yolg'iz elektron juftiga ega bo'lgan anionlar yoki molekulalar.
Nukleofillarga misollar: Cl - (xlorid ioni), OH - (gidroksid anioni), CH 3 O - (metoksid anioni), CH 3 COO - (atsetat anioni).
To'ldirilmagan orbitalga ega bo'lgan zarralar, aksincha, uni to'ldirishga moyil bo'ladi va shuning uchun molekulalarning elektron zichligi oshgan, manfiy zaryadli va yolg'iz elektron juftiga ega bo'lgan qismlariga tortiladi. Ular elektrofillar, elektronning "do'stlari", manfiy zaryad yoki elektron zichligi oshgan zarralardir.
Elektrofillar- to'ldirilmagan elektron orbitalga ega bo'lgan kationlar yoki molekulalar, uni elektronlar bilan to'ldirishga intiladi, chunki bu atomning yanada qulay elektron konfiguratsiyasiga olib keladi.
Hech qanday zarracha to'ldirilmagan orbitali elektrofil emas. Masalan, gidroksidi metall kationlari inert gazlar konfiguratsiyasiga ega va elektron olishga moyil emas, chunki ular past elektronga yaqinlik.
Bundan xulosa qilishimiz mumkinki, to'ldirilmagan orbital mavjudligiga qaramay, bunday zarralar elektrofil bo'lmaydi.
Asosiy reaktsiya mexanizmlari
Reaksiyaga kirishuvchi zarrachalarning uchta asosiy turi aniqlangan - erkin radikallar, elektrofillar, nukleofillar va uchta mos keladigan reaksiya mexanizmlari:
- erkin radikal;
- elektrofil;
- zerofil.
Reaksiyalarni reaksiyaga kirishuvchi zarrachalar turiga ko‘ra tasniflashdan tashqari, organik kimyoda molekulalarning tarkibini o‘zgartirish tamoyiliga ko‘ra to‘rt turdagi reaksiyalar ajratiladi: qo‘shish, almashtirish, ajratish yoki yo‘q qilish (ingliz tilidan. uchun yo'q qilish- olib tashlash, ajratish) va qayta tartibga solish. Qo'shish va almashtirish har uch turdagi reaktiv turlarning ta'siri ostida sodir bo'lishi mumkinligi sababli, bir nechtasini ajratib ko'rsatish mumkin. asosiyreaktsiyalar mexanizmlari.


Bundan tashqari, nukleofil zarrachalar - asoslar ta'sirida yuzaga keladigan yo'q qilish reaktsiyalarini ko'rib chiqamiz.
6. Yo'q qilish:
Alkenlarning (to'yinmagan uglevodorodlar) o'ziga xos xususiyati ularning qo'shilish reaktsiyalarini o'tkazish qobiliyatidir. Ushbu reaktsiyalarning aksariyati elektrofil qo'shilish mexanizmi bilan davom etadi.
Gidrogalogenlash (galogen qo'shilishi vodorod):
Alkenga galogen vodorod qo'shilganda vodorod ko'proq vodorodlanganga qo'shiladi uglerod atomi, ya'ni atomlari ko'proq bo'lgan atom vodorod, va halogen - kamroq vodorodlangan.

 Reaksiyalarni boshlang'ich va yakuniy moddalar soniga ko'ra tasnifi: 1. Qo'shish 2. Eliminatsiya (yo'q qilish) 3. O'zgartirish
Reaksiyalarni boshlang'ich va yakuniy moddalar soniga ko'ra tasnifi: 1. Qo'shish 2. Eliminatsiya (yo'q qilish) 3. O'zgartirish
 Reaksiyalarning tasnifi Bog’lanishning uzilish mexanizmiga ko’ra: 1. Gomolitik (radikal) radikallar 2. Geterolitik (ion) ionlar.
Reaksiyalarning tasnifi Bog’lanishning uzilish mexanizmiga ko’ra: 1. Gomolitik (radikal) radikallar 2. Geterolitik (ion) ionlar.
 Reaktsiya mexanizmi Mexanizm kimyoviy reaktsiyaning bosqichma-bosqich tavsifi bo'lib, oraliq mahsulot va zarrachalarni ko'rsatadi. Reaktsiya sxemasi: Reaktsiya mexanizmi:
Reaktsiya mexanizmi Mexanizm kimyoviy reaktsiyaning bosqichma-bosqich tavsifi bo'lib, oraliq mahsulot va zarrachalarni ko'rsatadi. Reaktsiya sxemasi: Reaktsiya mexanizmi:
 Reaksiyalarning reagentlar turi bo‘yicha tasnifi 1. Radikal Radikal juftlashtirilmagan elektronga ega bo‘lgan kimyoviy faol zarrachadir. 2. Elektrofil Elektrofil - elektron yetishmaydigan zarra yoki molekula, elektron yetishmaydigan atomga ega. 3. Nukleofil nukleofil - yakka elektron juftli atomga ega bo'lgan anion yoki neytral molekula.
Reaksiyalarning reagentlar turi bo‘yicha tasnifi 1. Radikal Radikal juftlashtirilmagan elektronga ega bo‘lgan kimyoviy faol zarrachadir. 2. Elektrofil Elektrofil - elektron yetishmaydigan zarra yoki molekula, elektron yetishmaydigan atomga ega. 3. Nukleofil nukleofil - yakka elektron juftli atomga ega bo'lgan anion yoki neytral molekula.
 Organik moddalardagi kimyoviy bog'lanish turlari Bog'lanishning asosiy turi kovalent (kamroq tarqalgan ionli) Sigma bog' (s-): Pi bog'i (-)
Organik moddalardagi kimyoviy bog'lanish turlari Bog'lanishning asosiy turi kovalent (kamroq tarqalgan ionli) Sigma bog' (s-): Pi bog'i (-)
 ALKANLAR - alifatik (yog'li) uglevodorodlar "Alifatos" - moy, yog' (yunoncha). Cn. H 2 n+2 To‘yingan uglevodorodlar
ALKANLAR - alifatik (yog'li) uglevodorodlar "Alifatos" - moy, yog' (yunoncha). Cn. H 2 n+2 To‘yingan uglevodorodlar
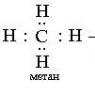
 Gomologik qator: CH 4 - metan C 2 H 6 - etan C 3 H 8 - propan C 4 H 10 - butan C 5 H 12 - pentan va boshqalar. C 6 H 14 - geksan C 7 H 16 - geptan C 8 H 18 - oktan C 9 H 20 - nonan C 10 H 22 - dekan va C 390 H 782 - nonokontatriktan (1985)
Gomologik qator: CH 4 - metan C 2 H 6 - etan C 3 H 8 - propan C 4 H 10 - butan C 5 H 12 - pentan va boshqalar. C 6 H 14 - geksan C 7 H 16 - geptan C 8 H 18 - oktan C 9 H 20 - nonan C 10 H 22 - dekan va C 390 H 782 - nonokontatriktan (1985)

 Metan molekulasining atom-orbital modeli Metan molekulasida uglerod atomida endi S- va P-orbitallar mavjud emas! Uning 4 gibrid SP 3 orbitallari energiya va shakl jihatidan teng bo'lib, vodorod atomining S orbitallari bilan 4 ta bog' hosil qiladi. H H 4 aloqalari
Metan molekulasining atom-orbital modeli Metan molekulasida uglerod atomida endi S- va P-orbitallar mavjud emas! Uning 4 gibrid SP 3 orbitallari energiya va shakl jihatidan teng bo'lib, vodorod atomining S orbitallari bilan 4 ta bog' hosil qiladi. H H 4 aloqalari

 Nitratsiya reaktsiyasi Konovalov Dmitriy Petrovich (1856 -1928) 1880. Alkanlar hisoblangan "kimyoviy o'liklarni" tiriltirishning birinchi muvaffaqiyatli urinishi. Alkanlarning nitrlanishi uchun sharoit topdim. Guruch. Manba: http: //rasmlar. yandex. ru.
Nitratsiya reaktsiyasi Konovalov Dmitriy Petrovich (1856 -1928) 1880. Alkanlar hisoblangan "kimyoviy o'liklarni" tiriltirishning birinchi muvaffaqiyatli urinishi. Alkanlarning nitrlanishi uchun sharoit topdim. Guruch. Manba: http: //rasmlar. yandex. ru.
 Kimyoviy xossalari I. C-H bog'larining uzilishi bilan sodir bo'ladigan reaksiyalar (almashtirish reaksiyalari): 1. galogenlanish 2. nitrlanish 3. sulfoxlorlanish II. C-C bog'larining uzilishi bilan sodir bo'ladigan reaksiyalar: 1. yonish 2. yorilish 3. izomerlanish.
Kimyoviy xossalari I. C-H bog'larining uzilishi bilan sodir bo'ladigan reaksiyalar (almashtirish reaksiyalari): 1. galogenlanish 2. nitrlanish 3. sulfoxlorlanish II. C-C bog'larining uzilishi bilan sodir bo'ladigan reaksiyalar: 1. yonish 2. yorilish 3. izomerlanish.


 Kimyogarni qanday topish mumkin? Agar kimyogar topmoqchi bo'lsangiz, kuya va ionlashtirilmagan nima ekanligini so'rang. Va agar u mo'ynali hayvonlar va mehnatni tashkil etish haqida gapira boshlasa, xotirjamlik bilan tark eting. Fantast yozuvchi, fan ommabop Isaak Asimov (1920–1992) rasm. Manba: http: //rasmlar. yandex. ru.
Kimyogarni qanday topish mumkin? Agar kimyogar topmoqchi bo'lsangiz, kuya va ionlashtirilmagan nima ekanligini so'rang. Va agar u mo'ynali hayvonlar va mehnatni tashkil etish haqida gapira boshlasa, xotirjamlik bilan tark eting. Fantast yozuvchi, fan ommabop Isaak Asimov (1920–1992) rasm. Manba: http: //rasmlar. yandex. ru.
 1. Galogenlanish reaksiyasi Xlorlash: RH + Cl 2 hv RCl + HCl Bromlash: RH + Br 2 hv RBr + HBr Masalan, metanning xlorlanishi: CH 4 + Cl 2 CH 3 Cl + HCl
1. Galogenlanish reaksiyasi Xlorlash: RH + Cl 2 hv RCl + HCl Bromlash: RH + Br 2 hv RBr + HBr Masalan, metanning xlorlanishi: CH 4 + Cl 2 CH 3 Cl + HCl
 Erkin radikal mexanizmining bosqichlari Reaksiya sxemasi: CH 4 + Cl 2 CH 3 Cl + HCl Reaksiya mexanizmi: I. Zanjirning boshlanishi - erkin radikallarning hosil bo'lish bosqichi. Cl Cl 2 Cl Radikal - faol zarracha, reaksiya tashabbuskori. – – Sahna isitish yoki yoritish shaklida energiya talab qiladi. Keyingi bosqichlar zulmatda, isitishsiz sodir bo'lishi mumkin.
Erkin radikal mexanizmining bosqichlari Reaksiya sxemasi: CH 4 + Cl 2 CH 3 Cl + HCl Reaksiya mexanizmi: I. Zanjirning boshlanishi - erkin radikallarning hosil bo'lish bosqichi. Cl Cl 2 Cl Radikal - faol zarracha, reaksiya tashabbuskori. – – Sahna isitish yoki yoritish shaklida energiya talab qiladi. Keyingi bosqichlar zulmatda, isitishsiz sodir bo'lishi mumkin.
 Erkin radikal mexanizmining bosqichlari II. Zanjirning o'sishi asosiy bosqichdir. CH 4 + Cl HCl + CH 3 + Cl 2 CH 3 Cl + Cl Bosqich bir nechta kichik bosqichlarni o'z ichiga olishi mumkin, ularning har birida yangi radikal hosil bo'ladi, lekin H emas!!! II bosqichda, asosiy bosqichda, asosiy mahsulot majburiy ravishda shakllanadi!
Erkin radikal mexanizmining bosqichlari II. Zanjirning o'sishi asosiy bosqichdir. CH 4 + Cl HCl + CH 3 + Cl 2 CH 3 Cl + Cl Bosqich bir nechta kichik bosqichlarni o'z ichiga olishi mumkin, ularning har birida yangi radikal hosil bo'ladi, lekin H emas!!! II bosqichda, asosiy bosqichda, asosiy mahsulot majburiy ravishda shakllanadi!
 Erkin radikal mexanizmining bosqichlari III. Zanjirni tugatish - radikallarning rekombinatsiyasi. Cl + Cl Cl 2 Cl + CH 3 CH 3 Cl CH 3 + CH 3 CH 3 -CH 3 Har qanday ikkita radikal birlashadi.
Erkin radikal mexanizmining bosqichlari III. Zanjirni tugatish - radikallarning rekombinatsiyasi. Cl + Cl Cl 2 Cl + CH 3 CH 3 Cl CH 3 + CH 3 CH 3 -CH 3 Har qanday ikkita radikal birlashadi.
 Almashtirishning selektivligi Tanlanganlik – selektivlik. Regioselektivlik - reaksiyalarning ma'lum bir sohasidagi selektivlik. Masalan, halogenlanish selektivligi: 45% 3% Xulosa? 55% 97%
Almashtirishning selektivligi Tanlanganlik – selektivlik. Regioselektivlik - reaksiyalarning ma'lum bir sohasidagi selektivlik. Masalan, halogenlanish selektivligi: 45% 3% Xulosa? 55% 97%
 Galogenlanishning selektivligi quyidagi omillarga bog'liq: Reaksiya shartlari. Past haroratlarda u ko'proq selektivdir. Galogenning tabiati. Galogen qanchalik faol bo'lsa, reaksiya shunchalik kam tanlanadi. F 2 C-C aloqalarini yo'q qilish bilan juda kuchli reaksiyaga kirishadi. I 2 bu sharoitda alkanlar bilan reaksiyaga kirishmaydi. Alkan tuzilishi.
Galogenlanishning selektivligi quyidagi omillarga bog'liq: Reaksiya shartlari. Past haroratlarda u ko'proq selektivdir. Galogenning tabiati. Galogen qanchalik faol bo'lsa, reaksiya shunchalik kam tanlanadi. F 2 C-C aloqalarini yo'q qilish bilan juda kuchli reaksiyaga kirishadi. I 2 bu sharoitda alkanlar bilan reaksiyaga kirishmaydi. Alkan tuzilishi.
 Alkan strukturasining o'rin almashish selektivligiga ta'siri. Agar alkandagi uglerod atomlari teng bo'lmasa, ularning har birining almashinishi har xil tezlikda sodir bo'ladi. Qarindosh almashtirish reaksiyasining tezligi Birlamchi. H atomi Ikkilamchi atom H Tert. H atomini xlorlash 1 3, 9 5, 1 bromlanish 1 82 1600 Xulosa?
Alkan strukturasining o'rin almashish selektivligiga ta'siri. Agar alkandagi uglerod atomlari teng bo'lmasa, ularning har birining almashinishi har xil tezlikda sodir bo'ladi. Qarindosh almashtirish reaksiyasining tezligi Birlamchi. H atomi Ikkilamchi atom H Tert. H atomini xlorlash 1 3, 9 5, 1 bromlanish 1 82 1600 Xulosa?
 Uchinchi darajali vodorod atomini olib tashlash uchun ikkilamchi va birlamchi atomni olib tashlashdan ko'ra kamroq energiya talab qilinadi! Alkan formulasi Gomoliz natijasi ED, kJ/mol CH 4 CH 3 + H 435 CH 3 - CH 3 C 2 H 5 + H 410 CH 3 CH 2 CH 3 (CH 3)2 CH + H 395 (CH 3) 3 CH (CH 3)3 C + H 377
Uchinchi darajali vodorod atomini olib tashlash uchun ikkilamchi va birlamchi atomni olib tashlashdan ko'ra kamroq energiya talab qilinadi! Alkan formulasi Gomoliz natijasi ED, kJ/mol CH 4 CH 3 + H 435 CH 3 - CH 3 C 2 H 5 + H 410 CH 3 CH 2 CH 3 (CH 3)2 CH + H 395 (CH 3) 3 CH (CH 3)3 C + H 377
 Reaktsiyalar yo'nalishi Har qanday reaksiya asosan barqarorroq oraliq zarracha hosil bo'lish yo'nalishida boradi!
Reaktsiyalar yo'nalishi Har qanday reaksiya asosan barqarorroq oraliq zarracha hosil bo'lish yo'nalishida boradi!
 Radikal reaksiyalardagi oraliq zarra erkin radikaldir. Eng barqaror radikal eng oson shakllanadi! Radikallarning barqarorlik qatori: R 3 C > R 2 CH > RCH 2 > CH 3 Alkil guruhlari elektron beruvchi ta'sir ko'rsatadi, buning natijasida ular radikalni barqarorlashtiradi.
Radikal reaksiyalardagi oraliq zarra erkin radikaldir. Eng barqaror radikal eng oson shakllanadi! Radikallarning barqarorlik qatori: R 3 C > R 2 CH > RCH 2 > CH 3 Alkil guruhlari elektron beruvchi ta'sir ko'rsatadi, buning natijasida ular radikalni barqarorlashtiradi.
 Sulfoxlorlanish reaksiyasi Reaksiya sxemasi: RH + Cl 2 + SO 2 RSO 2 Cl + HCl Reaksiya mexanizmi: 1. Cl Cl 2 Cl 2. RH + Cl R + HCl R + SO 2 RSO 2 + Cl 2 RSO 2 Cl + Cl va boshqalar. . va hokazo 3. 2 Cl Cl 2 va boshqalar.
Sulfoxlorlanish reaksiyasi Reaksiya sxemasi: RH + Cl 2 + SO 2 RSO 2 Cl + HCl Reaksiya mexanizmi: 1. Cl Cl 2 Cl 2. RH + Cl R + HCl R + SO 2 RSO 2 + Cl 2 RSO 2 Cl + Cl va boshqalar. . va hokazo 3. 2 Cl Cl 2 va boshqalar.
 Konovalov reaktsiyasi D.P. Konovalov bo'yicha nitrlash suyultirilgan nitrat kislotaning 140 o haroratda ta'sirida amalga oshiriladi. C. Reaksiya sxemasi: RH + HNO 3 RNO 2 + H 2 O
Konovalov reaktsiyasi D.P. Konovalov bo'yicha nitrlash suyultirilgan nitrat kislotaning 140 o haroratda ta'sirida amalga oshiriladi. C. Reaksiya sxemasi: RH + HNO 3 RNO 2 + H 2 O
 Konovalov reaksiya mexanizmi HNO 3 N 2 O 4 1. N 2 O 4 2 NO 2 2. RH + NO 2 R + HNO 2 R + HNO 3 RNO 2 + OH RH + OH R + H 2 O va boshqalar 3 .Ochiq sxema.
Konovalov reaksiya mexanizmi HNO 3 N 2 O 4 1. N 2 O 4 2 NO 2 2. RH + NO 2 R + HNO 2 R + HNO 3 RNO 2 + OH RH + OH R + H 2 O va boshqalar 3 .Ochiq sxema.

 Alkenlar toʻyinmagan uglevodorodlar boʻlib, bitta C=C bogʻlanishi, Cn. H 2 n S=S – alkenlarning funksional guruhi
Alkenlar toʻyinmagan uglevodorodlar boʻlib, bitta C=C bogʻlanishi, Cn. H 2 n S=S – alkenlarning funksional guruhi



 Alkenlarning kimyoviy xossalari Umumiy xususiyatlari Alkenlar birikmalarning reaktiv sinfidir. Ular ko'plab reaktsiyalarni boshdan kechiradilar, ularning aksariyati kuchsizroq pi aloqasini buzish orqali sodir bo'ladi. E C-C (s-) ~ 350 KJ/mol E C=C (-) ~ 260 KJ/mol
Alkenlarning kimyoviy xossalari Umumiy xususiyatlari Alkenlar birikmalarning reaktiv sinfidir. Ular ko'plab reaktsiyalarni boshdan kechiradilar, ularning aksariyati kuchsizroq pi aloqasini buzish orqali sodir bo'ladi. E C-C (s-) ~ 350 KJ/mol E C=C (-) ~ 260 KJ/mol
 Xarakterli reaksiyalar Qo'shish reaksiyaning eng xarakterli turidir. Qo'sh bog'lanish elektron donordir, shuning uchun u qo'shishga intiladi: E - elektrofillar, kationlar yoki radikallar
Xarakterli reaksiyalar Qo'shish reaksiyaning eng xarakterli turidir. Qo'sh bog'lanish elektron donordir, shuning uchun u qo'shishga intiladi: E - elektrofillar, kationlar yoki radikallar
 Elektrofil qo'shilish reaktsiyalariga misollar 1. Galogenlarning qo'shilishi - Hamma galogenlar qo'shilmaydi, faqat xlor va brom! – Neytral halogen molekulasining qutblanishi qutbli erituvchi ta’sirida yoki alkenning qo‘sh bog‘lanishi ta’sirida sodir bo‘lishi mumkin. Qizil-jigarrang brom eritmasi rangsiz bo'ladi
Elektrofil qo'shilish reaktsiyalariga misollar 1. Galogenlarning qo'shilishi - Hamma galogenlar qo'shilmaydi, faqat xlor va brom! – Neytral halogen molekulasining qutblanishi qutbli erituvchi ta’sirida yoki alkenning qo‘sh bog‘lanishi ta’sirida sodir bo‘lishi mumkin. Qizil-jigarrang brom eritmasi rangsiz bo'ladi
 Elektrofil qo'shilish Reaksiyalar xona haroratida sodir bo'ladi va yorug'likni talab qilmaydi. Mexanizm iondir. Reaktsiya sxemasi: XY = Cl 2, Br 2, HCl, HBr, HI, H 2 O
Elektrofil qo'shilish Reaksiyalar xona haroratida sodir bo'ladi va yorug'likni talab qilmaydi. Mexanizm iondir. Reaktsiya sxemasi: XY = Cl 2, Br 2, HCl, HBr, HI, H 2 O

 Sigma kompleksi karbokation - uglerod atomida musbat zaryadga ega bo'lgan zarrachadir. Agar reaksiya muhitida boshqa anionlar mavjud bo'lsa, ular ham karbokatsiyaga qo'shilishi mumkin.
Sigma kompleksi karbokation - uglerod atomida musbat zaryadga ega bo'lgan zarrachadir. Agar reaksiya muhitida boshqa anionlar mavjud bo'lsa, ular ham karbokatsiyaga qo'shilishi mumkin.
 Masalan, suvda erigan brom qo'shilishi. C=C qo‘sh bog‘lanishiga bunday sifatli reaksiya brom eritmasining rangi o‘zgarishi va ikkita mahsulot hosil bo‘lishi bilan boradi:
Masalan, suvda erigan brom qo'shilishi. C=C qo‘sh bog‘lanishiga bunday sifatli reaksiya brom eritmasining rangi o‘zgarishi va ikkita mahsulot hosil bo‘lishi bilan boradi:


 Nosimmetrik alkenlarga qo'shilish Qo'shishning regioselektivligi! Markovnikov qoidasi (1869): kislotalar va suv nosimmetrik alkenlarga shunday qo'shiladiki, vodorod ko'proq vodorodlangan uglerod atomiga qo'shiladi.
Nosimmetrik alkenlarga qo'shilish Qo'shishning regioselektivligi! Markovnikov qoidasi (1869): kislotalar va suv nosimmetrik alkenlarga shunday qo'shiladiki, vodorod ko'proq vodorodlangan uglerod atomiga qo'shiladi.
 Markovnikov Vladimir Vasilevich (1837 - 1904) Qozon universiteti bitiruvchisi. 1869 yildan - kimyo kafedrasi professori. Ilmiy maktab asoschisi. Guruch. Manba: http: //rasmlar. yandex. ru.
Markovnikov Vladimir Vasilevich (1837 - 1904) Qozon universiteti bitiruvchisi. 1869 yildan - kimyo kafedrasi professori. Ilmiy maktab asoschisi. Guruch. Manba: http: //rasmlar. yandex. ru.
 Markovnikov qoidasini tushuntirish Reaksiya eng barqaror oraliq zarracha - karbokation hosil qilish orqali boradi. birlamchi ikkilamchi, barqarorroq
Markovnikov qoidasini tushuntirish Reaksiya eng barqaror oraliq zarracha - karbokation hosil qilish orqali boradi. birlamchi ikkilamchi, barqarorroq
 Karbokationlarning barqarorlik qatori: uchinchi darajali ikkilamchi birlamchi metil Markovnikovning zamonaviy formuladagi qoidasi: alkenga proton qo'shilishi barqarorroq karbokatsiya hosil bo'lishi bilan sodir bo'ladi.
Karbokationlarning barqarorlik qatori: uchinchi darajali ikkilamchi birlamchi metil Markovnikovning zamonaviy formuladagi qoidasi: alkenga proton qo'shilishi barqarorroq karbokatsiya hosil bo'lishi bilan sodir bo'ladi.

 Anti-Markovnikov qo'shilishi CF 3 -CH=CH 2 + HBr CF 3 -CH 2 Br Rasmiy ravishda reaksiya Markovnikov qoidasiga zid keladi. CF 3 – elektronni tortib oluvchi o‘rinbosar Boshqa elektron tortib oluvchi moddalar: NO 2, SO 3 H, COOH, galogenlar va boshqalar.
Anti-Markovnikov qo'shilishi CF 3 -CH=CH 2 + HBr CF 3 -CH 2 Br Rasmiy ravishda reaksiya Markovnikov qoidasiga zid keladi. CF 3 – elektronni tortib oluvchi o‘rinbosar Boshqa elektron tortib oluvchi moddalar: NO 2, SO 3 H, COOH, galogenlar va boshqalar.
 Anti-Markovnikov qo'shilishi ancha barqaror beqaror CF 3 - elektron qabul qiluvchi, karbokatsiyani beqarorlashtiradi.Reaksiya faqat rasmiy ravishda Markovnikov qoidasiga zid keladi. Aslida, u unga bo'ysunadi, chunki u yanada barqaror karbokatatsiyadan o'tadi.
Anti-Markovnikov qo'shilishi ancha barqaror beqaror CF 3 - elektron qabul qiluvchi, karbokatsiyani beqarorlashtiradi.Reaksiya faqat rasmiy ravishda Markovnikov qoidasiga zid keladi. Aslida, u unga bo'ysunadi, chunki u yanada barqaror karbokatatsiyadan o'tadi.
 Xarash peroksid effekti X CH 3 -CH=CH 2 + HBr CH 3 -CH 2 Br X = O 2, H 2 O 2, ROOR Erkin radikal mexanizmi: 1. H 2 O 2 2 OH + HBr H 2 O + Br 2 CH 3 -CH=CH 2 + Br CH 3 -CH -CH 2 Br barqarorroq radikal CH 3 -CH -CH 2 Br + HBr CH 3 -CH 2 Br + Br va boshqalar 3. Har qanday ikkita radikal o'zaro birlashadi. .
Xarash peroksid effekti X CH 3 -CH=CH 2 + HBr CH 3 -CH 2 Br X = O 2, H 2 O 2, ROOR Erkin radikal mexanizmi: 1. H 2 O 2 2 OH + HBr H 2 O + Br 2 CH 3 -CH=CH 2 + Br CH 3 -CH -CH 2 Br barqarorroq radikal CH 3 -CH -CH 2 Br + HBr CH 3 -CH 2 Br + Br va boshqalar 3. Har qanday ikkita radikal o'zaro birlashadi. .
 Elektrofil qo'shilish 3. Hidratsiya - suv qo'shilishi - reaktsiya kislota katalizatorlari, ko'pincha sulfat kislota ishtirokida sodir bo'ladi. - Reaksiya Markovnikov qoidasiga bo'ysunadi. Spirtli ichimliklarni olishning arzon usuli
Elektrofil qo'shilish 3. Hidratsiya - suv qo'shilishi - reaktsiya kislota katalizatorlari, ko'pincha sulfat kislota ishtirokida sodir bo'ladi. - Reaksiya Markovnikov qoidasiga bo'ysunadi. Spirtli ichimliklarni olishning arzon usuli
 Imtihon paytida akademik Ivan Alekseevich Kablukov talabadan laboratoriyada vodorod qanday ishlab chiqarilishini aytib berishni so'raydi. "Simobdan", deb javob beradi u. “Siz “simobdan yasalgan” degani qanday tushunasiz? ! Ular odatda "sinkdan qilingan" deyishadi, lekin simobdan qilingan narsa asldir. Reaktsiya yozing." Talaba yozadi: Hg = H + g Va aytadi: "Merkuriy isitiladi; u H va g ga parchalanadi. H - vodorod, u engil va shuning uchun uchib ketadi, lekin g - tortishishning tezlashishi, og'ir, qoladi. "Bunday javob uchun siz A qo'yishingiz kerak", deydi Kablukov. - Keling, rekordlar kitobini olaylik. Men ham birinchi navbatda "besh" ni qizdiraman. "Uch" uchib ketadi, lekin "ikki" qoladi.
Imtihon paytida akademik Ivan Alekseevich Kablukov talabadan laboratoriyada vodorod qanday ishlab chiqarilishini aytib berishni so'raydi. "Simobdan", deb javob beradi u. “Siz “simobdan yasalgan” degani qanday tushunasiz? ! Ular odatda "sinkdan qilingan" deyishadi, lekin simobdan qilingan narsa asldir. Reaktsiya yozing." Talaba yozadi: Hg = H + g Va aytadi: "Merkuriy isitiladi; u H va g ga parchalanadi. H - vodorod, u engil va shuning uchun uchib ketadi, lekin g - tortishishning tezlashishi, og'ir, qoladi. "Bunday javob uchun siz A qo'yishingiz kerak", deydi Kablukov. - Keling, rekordlar kitobini olaylik. Men ham birinchi navbatda "besh" ni qizdiraman. "Uch" uchib ketadi, lekin "ikki" qoladi.

 Laboratoriyada ikkita kimyogar: - Vasya, qo'lingni shu stakanga qo'ying. - Men tashladim. - Biror narsani his qilyapsizmi? - Yo'q. - Demak, boshqa stakanda sulfat kislota bor.
Laboratoriyada ikkita kimyogar: - Vasya, qo'lingni shu stakanga qo'ying. - Men tashladim. - Biror narsani his qilyapsizmi? - Yo'q. - Demak, boshqa stakanda sulfat kislota bor.
 Aromatik uglevodorodlar Aromatik - xushbo'ymi? ? Aromatik birikmalar - bu benzol va kimyoviy xulq-atvorda unga o'xshash moddalar!
Aromatik uglevodorodlar Aromatik - xushbo'ymi? ? Aromatik birikmalar - bu benzol va kimyoviy xulq-atvorda unga o'xshash moddalar!